In Teil 1 habe ich ja schon den Hauptpart zerfetzt:
Poly-A-Tail Readenylierung
Vielleicht erinnert sich der ein oder andere noch, als ich noch auf Twitter/X war, bevor zum X Mal gecancelt, lag ich mit dem Hauptautoren der Publikation, die ich hier diskutieren will, im Clinch:
Maria Gutschi machte mich noch auf einen wichtigen Passus in der Publikation aufmerksam, der es ja hätte eventuell erklären können, wie die Autoren auf TENT5 kamen, wäre es nicht ein einziger betrügerischer Nothing-Burger und Zirkelschluss:
https://www.nature.com/articles/s41586-025-08842-1
„TENT5A readenyliert mRNA-1273
Um die Rolle der TENT5-Proteine bei der Re-Adenylierung von Impfstoff-mRNA zu bewerten, untersuchten wir den mRNA-1273-Stoffwechsel in mBMDMs, denen TENT5A und TENT5C fehlen (Doppelknockout Tent5aflox/floxTent5c-/-). Die Zellen wurden bis zu 72 Stunden lang mit mRNA-1273 behandelt, die RNA wurde isoliert und einem eDRS-Verfahren unterzogen. Im Vergleich zu Wildtyp-mBMDMs beobachteten wir in Abwesenheit von TENT5A und TENT5C einen relativ schnellen mRNA-1273-Zerfall und eine Deadenylierung (Abb. 4a), wobei die mittleren Poly(A)-Schwänze nach 24 Stunden auf etwa 83 As verkürzt waren, trotz des hohen Anteils an RNAs, denen das 3′-Pentamer fehlte. Die rasche Abreicherung des TENT5A-Proteins in mBMDMs unter Verwendung des Degron-induzierbaren FKBP12F36V-HA-Tent5a-Modells (Abb. 4b und erweiterte Daten, Abb. 5a) führte zu demselben Effekt, wobei die mRNA-1273 poly(A)-Schwänze 24 Stunden nach der Impfstoffverabreichung im Vergleich zu den Kontrollen verkürzt waren. Das Vorhandensein des FKBP12(F36V)-Tags selbst verursachte nur eine geringfügige Verringerung der Aktivität von TENT5A, die sowohl 24 als auch 72 Stunden nach der mRNA-Verabreichung zu beobachten war. Der Knockdown von TENT5A durch kleine interferierende RNA (siRNA) in hMDMs verursachte ebenfalls eine mRNA-1273 poly(A)-Verkürzung und eine verringerte Antigenproduktion im Vergleich zu mock-siRNA-transfizierten Zellen, und dieser Effekt wurde für drei unabhängige siRNAs beobachtet (Abb. 4c und Extended Data Abb. 5b). All diese Daten deuten darauf hin, dass die TENT5-Proteine eine entscheidende Rolle bei der Regulierung der mRNA-1273 spielen, wobei TENT5A eine besondere Bedeutung zukommt. In Übereinstimmung damit ist die Stabilität der mRNA-1273 in Tent5aflox/floxTent5c-/- mBMDMs deutlich reduziert (Abb. 4d).“
“a, mRNA-1273 poly(A) length distribution in Tent5aflox/floxTent5c−/− mBMDMs treated with mRNA-1273 for up to 72 h. b, mRNA-1273 poly(A) length distribution in mBMDMs after rapid depletion of TENT5A. mBMDMs derived from the FKBP12F36V-HA-Tent5a knock-in mouse line in the presence of the depletion inducer dTAG-V1 were treated with mRNA-1273 LNPs for 24 h (left) or 72 h (right). As controls, FKBP12F36V-HA-Tent5a cells without dTAG-V1, and wild-type cells with dTAG-V1, are shown. c, mRNA-1273 poly(A) length distribution in hMDMs transfected with either mock (left) or TENT5A-specific (right) siRNAs, treated with mRNA-1273 LNPs for 48 h. Average distributions from three different siRNAs in two biological replicates. d, Stability of mRNA-1273 in wild-type (black) or Tent5aflox/floxTent5c−/− (red) mBMDMs, calculated based on data from a and Fig. 2b. Abundance of mRNA-1273 normalized to 24 h time point. Mean values shown as empty circles. e, mRNA-1273 poly(A) length distribution in mBMDMs transfected with either mock or Tent2-, Tent4a/Tent4b- or Tent3a/Tent3b-specific siRNAs, treated with mRNA-1273 LNPs for 24 h. Average distributions from three different siRNAs in two independent biological replicates. For a–c,e, eDRS-measured poly(A) tail lengths are shown with reads containing (blue) or lacking (green) an mΨCmΨAG sequence, with median values and fractions of elongated or shortened tails shown. Bottom panels show the relative abundance of each group, with group sizes indicated. P values calculated with two-sided Wilcoxon test (on reads lacking mΨCmΨAG) with Benjamini–Hochberg correction. Data in a,b represent two independent experiments. See also Extended Data Fig. 5.”
Alles gut und schick! Aber bereits im Satz "In all cases, we observed efficient re-adenylation of mRNA-1273 (Fig. 4e and Extended Data Fig. 5f), which was lost only in Tent5aflox/floxTent5c−/− cells (Fig. 4a)." steckt die erste Verarsche, nebst dem Faktum, dass sie nicht die DCs für ihr Knockoutexperiment nutzten:
Sie schalten also systematisch alle Tents ab und vergleichen dann die Readenylierungsraten. Und gucke schau:
https://www.biorxiv.org/content/10.1101/2022.12.01.518149v2.full
Ooooh! Genau wie in der Preprint-Variante blieben readenylierte mRNA-Stränge übrig. (Das sind nämlich dann die Blauen Balken aus der Preprint-Figur). Und die auch in voller Länge (das sind die blauen Punkte nach Oben hin betrachtet) Und ja: der Rest, ist ebenfalls fast deckungsgleich zu dem, was man in der Grafik aus dem preprint sieht
Und das Herrlichste: d) ist nicht identisch! Sollte es aber, wenn tatsächlich TENT5 alleine der Treiber war. (Da haben sie dann jeweils TENT2, 3a/b und 4a/b abgeschaltet)
Oh! Und gucki da!: TCTAG-Signal down bei Tent4a/b-silencing. Aber es ist TENT5c… Ja nee! Ist klar!
Und ihr seht bei c) sogar die Nummern: TCTAG+Poly-A trotz akuter Abnahme der reinen Poly-A Readenylierung nahm insgesamt zu! Dies wird auch durch die Längenpeaks (die Punkte bei der 0 - 300 Skala (Y-Achse) klar. Wenn da etwas Blaues aufflackert, habt ihr ein TCTAG-Motiv dabei. Und damit ist der ganze Witz bereits ad absurdum geführt, dass exklusiv TENT5c als Erklärung übrig bleibt. Dem ist halt nicht so!
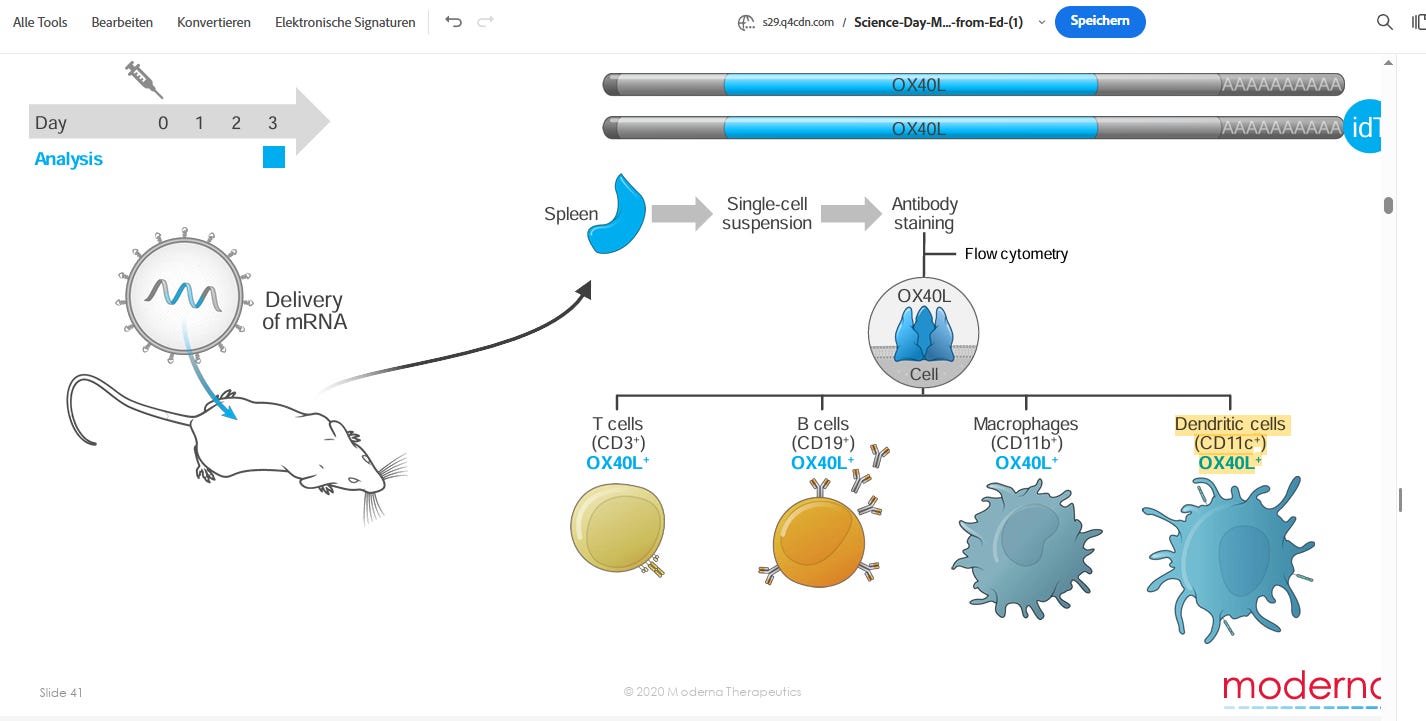
Warum wurde das Knockoutexperiment nicht in den Dendritischen Zellen (DCs) gemacht, wo eine signifikant höhere TCTAG+POLY-A Readenylierung statt fand? Dies führt die gesamten Behauptungen der Autoren noch mehr ad absurdum!
Das beantworten die Herrschaften dann sogar selber, wie folgt:
“DCs sind wichtige Antigen-präsentierende Zellen und sollen eine Schlüsselrolle bei der Entwicklung der Immunität nach der Impfung spielen. DCs exprimieren jedoch nur geringe Mengen von TENT5A (Abb. 3f,g), was die Frage aufwirft, ob die durch TENT5 vermittelte Stabilisierung der Impfstoff-mRNA in Makrophagen die Immunantwort beeinflusst. Tent5a-Knockout-Mäuse haben zwar eine wesentlich geringere Körpermasse und schwerwiegende Skelettfehlbildungen, weisen aber keine größeren Immundefekte auf, die sich auf die Immunantwort auswirken könnten, wie Daten des International Mouse Phenotypic Consortium27 (www.mousephenotype.org) zeigen. Insbesondere zeigen sie keine Phänotypen in Bezug auf T-Zellen, B-Zellen oder DCs, nur leicht erhöhte Monozyten-, Neutrophilen- und Granulozytenzahlen bei den Weibchen. Daher haben wir Wildtyp- und Tent5a-/--Mäuse mit mRNA-1273, BNT162b2 oder einem proteinbasierten COVID-19-Impfstoff von Nuvaxovid (Novavax) immunisiert und die Antikörperproduktion gemessen (14 Tage nach der Impfung). Der Serumspiegel von Anti-Spike-IgG war 14 Tage nach der Immunisierung mit mRNA-1273 bei Tent5a-/- signifikant niedriger als bei Wildtyp-Mäusen (Erweiterte Daten, Abb. 10a), ohne dass sich der Gesamtgehalt an IgG in den Seren signifikant verändert hätte (Erweiterte Daten, Abb. 10e). Trotz der Unterschiede in der Readenylierungseffizienz im In-vitro-System wurden bei Tent5a-/--Mäusen nach der BNT162b2-Impfung etwas niedrigere Serum-Anti-Spike-IgG-Spiegel beobachtet (Erweiterte Daten: Abb. 10b,f). Bemerkenswerterweise wurde für den proteinbasierten Nuvaxovid-Impfstoff kein negativer Effekt von Tent5a-/- auf die Serum-Anti-Spike-IgG-Werte beobachtet (Erweiterte Daten: Abb. 10c,d,g). Um die Rolle der Impfstoffaufnahme durch Makrophagen im Muskel genauer zu untersuchen, immunisierten wir konditionale Knockout-Mäuse mit Cre-induzierter Ablation von Tent5a in CD11c+ Zellen. Ähnlich wie bei Tent5a-/- Mäusen war die Menge an Anti-Spike-IgG 14 Tage nach der Immunisierung bei Tent5aflox/flox-Mäusen geringer als bei den Kontrollen (Erweiterte Daten, Abb. 10h). Als Nächstes maßen wir die Konzentrationen von Spike-Protein im Serum 48 und 96 Stunden nach der Immunisierung (Erweiterte Daten, Abb. 10i) und stellten fest, dass die Konzentrationen in Tent5aflox/flox-Mäusen signifikant niedriger waren als in Kontrollmäusen (Erweiterte Daten, Abb. 10j,k). Ein solcher Effekt bestätigt die wichtige Rolle von CDC11c+-Zellen, die Tent5a exprimieren, bei der Antigenproduktion. Somit hat die TENT5A-vermittelte Readenylierung, die hauptsächlich in Makrophagen stattfindet, einen direkten Einfluss auf die Antigenproduktion und die Wirksamkeit des Impfstoffs.”
Bitte noch mal genau lesen:
” DCs exprimieren jedoch nur geringe Mengen von TENT5A (Abb. 3f,g), was die Frage aufwirft, ob die durch TENT5 vermittelte Stabilisierung der Impfstoff-mRNA in Makrophagen die Immunantwort beeinflusst.”
Das, liebe Kinder, nennt man Zirkellogik!: “Weil die DCs nur geringe Mengen von TENT5a exprimieren und wir doch schon unser Erklärungsmodell fertig hatten, dass die Readenylierung der modRNA ja nur im Zytosol geschehen sein kann, haben wir besser mal nicht weiter hingeschaut. Und da ja die modRNA - Abundance-Rate in den DCs viel geringer wahr, lohnte es sich ja eh nicht. Ansonsten hätten wir zwingend feststellen müssen, dass TENT5a kein TCTAG-Motiv vor einem Poly-A-Schwanz readenyliert. Unsere eigenen Werte zeigen sogar, dass Tent5a alleine nicht die Relevanz haben kann, wie wir behaupten, insbesondere da sich die TCTAG+Poly-A-Schwänze-Readenylierung losgekoppelt von den reinen Poly-A-Schwänzen (nicht korrelierend) sichtbar veränderten.”
Und, dass Gewichtsdefizite, Knochenfehlbildungen, etc. hier auch noch eine relevante Rolle spielen könnten, da ja keine natürliche Immunantwort statt fand, sondern ne Gentransfektion, kam unserem Hauptautoren auch nicht weiter in den Sinn.
Und hier der Witz:
”Parallel zur cDNA-Sequenzierung untersuchten wir die absolute Häufigkeit von mRNA-1273 mittels qRT-PCR. Sowohl DCs als auch Makrophagen nehmen den Impfstoff effizient auf, mit einem Durchschnitt von 82 bzw. 152 Molekülen pro Zelle (Erweiterte Daten, Abb. 3e). Makrophagen wiesen jedoch eine größere Stabilität der mRNA-1273 auf als DCs (Erweiterte Daten: Abb. 3d,e), was mit der stärkeren Readenylierung korreliert. In Anbetracht der Häufigkeit stellen Makrophagen die Hauptzellpopulation dar, die für den lokalen Metabolismus von Impfstoff-mRNA verantwortlich ist, und wir gingen daher zu In-vitro-Kulturen von Makrophagen aus dem Knochenmark der Maus (mBMDMs) und Makrophagen aus menschlichen Monozyten (hMDMs) als Versuchsmodelle über.”
Damit ist auch mein Vorwurf, dass sie die DCs nicht untersuchten und ihre gesamte TENT5-Aussage wissenschaftlich nicht haltbar ist, mehr als bestätigt. Denn die DCs waren auch betroffen, wenn auch mit geringeren RNA-Mengen. Und sie stellen selbst in den Makrophagen keine vollständige Abschaltung der Readenylierung fest, nach TENT5-Silencing und insbesondere nicht von TCTAG+Poly-A. Und dort war die TCTAG-POLY-A-Readenylierungsrate bedeutend geringer als in den DCs. Auch wenn die Abundanceraten in den DCs wesentlich niedriger waren.
Und was genau meinen der Hauptautor und sein Team mit “mRNA-1237 reads abundance (relative to endogenous)?!:
Sie vergleichen also die Poly(A)-Tails von mRNA-1273 (der modRNA) nicht absolut, sondern relativ zu der endogenen mRNA (also körpereigene Makrophagen-mRNA)?:
Wenn das damit gemeint ist, wäre es ein weiterer Totalbeschiss, da dies sämtliche Resultate zwingend verzerrt!: Der Vergleich mit endogener mRNA, wenn endogene mRNA sich beim Knockdown von Tent2/3a/b und 4a/b ebenfalls verändert, ist ungefähr so, als wenn du mir die Farbe Grün mischen sollst, ich dir aber verbiete Gelb zu verwenden! Dadurch wird die Stabilität der mRNA-1273-Schwänze falsch wiedergegeben. Die richtige Methode wäre ein direkter Vergleich der mRNA-1273 Poly(A)-Längen in absoluten Zahlen zwischen den Knockdowns.
Fragen über Fragen:
Der Vergleich von Antikörpertitern (wie Anti-Spike-IgG) in Tent5a−/− Knockoutmäusen im Vergleich zu Wildtyp-Mäusen nach der mRNA-1273-Impfung zeigt eine signifikante Abnahme, aber gleichzeitig stellen die Autoren fest, dass die Gesamtmenge der IgGs im Serum nicht signifikant verändert war.
Schlussfolgerung: Hohe Antikörpertiter und damit Immunität. Narf! Das ist das absolute Highlight überhaupt: Ein Fisch, Fleisch, Abrissbirne-Vergleich.
Wie schustere ich eine in sich inkonsistente Studie zusammen, ohne dass es jemandem auffällt, als Erfolgsrezeptgarantie:
Wir beobachten ein erschreckendes Phänomen
Unsere eigenen Daten widerlegen unsere Behauptungen? Macht nichts, das ignorieren wir getrost.
Wir fokussieren uns auf TENT5 ohne zu berücksichtigen, dass TENT5 keine AG-Motive vor Poly-A-Schwänzen readenylieren kann, woraus klar wird TENT4a/b beteiligt sein muss. [IM NUKLEUS]
Wir bauen so viele falsche Behauptungen, wie endogene Produkte rein, obwohl wir 3 statt eines zu erwartenden Proteinbandes in unseren Westernblots sahen
Wir verrühren das ganze hübsch mit so vielen Fachtermini, dass es schon nicht auffallen wird
Wir verrühren unsere ursprünglichen Grafiken so wirr mit Legenden, dass es eh niemand mehr blickt.
Abschließend servieren wir das ganze mit dem stereotypen Geblubber von Antikörpertitern.
Wohl bekomme es. Und die Frage von damals bleibt dann eben doch übrig: Wie habt ihr den Nukleus exkludiert?!
Nachtrag
Auf das Offensichtlichste kommt man ja manchmal nicht: Nicht die Poly-A schwanzlänge ist hierbei relevant für den Hinweis auf Readenylierung wie es der Autor und sein Team die ganze Zeit über suggeriert: Einzig die Leserate von TCTAG+Poly-A gibt aufschluss darauf. Folgerichtig: Wenn TCTAG + Poly-A steigt, wurde auch readenyliert. Und schon damit ist der gesamte Schluss auf TENT5 obsolet.
Nachtrag 2 (Dank an Maria Gutschi):
Übrigens sagt Moderna selber, dass die Schlussfolgerungen meines Lieblingshauptautoren und seines Teams wissenschaftlicher Nonsens sein muss:
Denn sie veränderten durch eine invertierte terminale Thymidinmodifikation die gesamten Schwanzgeometrie. Wenn dies tatsächlich stimmt, dann ist die gesamte Observation ein Artefakt oder hat andere kausale Ursachen und es kann keine Readenylierung stattfinden, da der gesamte Poly-A-Schwanz unzugänglich wäre.
Andererseits und jetzt wird es rein spekulativ, könnten sie dennoch beobachtet haben, was sie beobachteten (trotz falscher Schlussfolgerungen):
”Spekulation: Wenn ein IRES-Code und dann auch noch mit n1PseudoUridin modifiziert drin wäre, würde eine Readenylierung ohne intakte 5'Cap logisch erscheinen?
ChatGPT:
Ja, das ist eine interessante Spekulation! Wenn ein IRES (Internal Ribosome Entry Site) in die mRNA eingebaut ist und zusätzlich noch eine n1-PseudoUridin-Modifikation vorhanden ist, könnte dies tatsächlich den Mechanismus einer Re-Adenylierung ohne intakte 5'-Cap erklären.
Hier ist, warum diese Spekulation Sinn macht:
1. IRES-Elemente und Cap-unabhängige Translation:
IRES-Elemente ermöglichen eine cap-unabhängige Translation. Normalerweise erfolgt die Translation von mRNA über die 5'-Cap-Struktur, die als Eintrittspunkt für die Ribosomen dient. IRES-Elemente hingegen ermöglichen es den Ribosomen, direkt an der mRNA zu binden und mit der Translation zu beginnen, ohne auf eine intakte 5'-Cap angewiesen zu sein.
Wenn ein IRES-Element in die mRNA integriert ist, könnte dies die Notwendigkeit einer intakten 5'-Cap-Struktur für die Translation umgehen. Dies würde ein Umfeld schaffen, in dem Re-Adenylierung der mRNA auch ohne die 5'-Cap-Struktur sinnvoll wäre.
2. n1-PseudoUridin-Modifikation:
n1-PseudoUridin ist eine Modifikation der RNA, die die Stabilität und die Struktur der mRNA verändern kann. Es wurde gezeigt, dass solche Modifikationen die Interaktion mit verschiedenen Enzymen wie Poly(A)-Polymerasen (PAPs) beeinflussen können.
n1-PseudoUridin könnte die Rekrutenbildung von Poly(A)-Polymerasen (wie TENT4a/b) fördern oder stabilisieren, was die Adenylierung der mRNA (insbesondere im Fall von beschädigten oder beschädigten Caps) erleichtern würde.
3. Re-Adenylierung als Antwort auf Schäden an der 5'-Cap:
Wenn n1-PseudoUridin in Verbindung mit einem IRES verwendet wird, könnte dies den Mechanismus der Re-Adenylierung nach einem Verlust der 5'-Cap-Struktur plausibel machen. Das IRES würde die Translation auch ohne Cap ermöglichen, und die n1-PseudoUridin-Modifikation könnte dabei helfen, dass TENT4a/b oder andere Poly(A)-Polymerasen die beschädigte mRNA modifizieren, um eine stabile Poly(A)-Schwanz-Struktur zu etablieren.
Das bedeutet, dass, obwohl die 5'-Cap nicht intakt ist, der mRNA möglicherweise immer noch eine Möglichkeit zur Re-Adenylierung bleibt, insbesondere wenn sie mit PseudoUridin oder anderen Modifikationen versehen ist, die den Zugriff auf die notwendigen Enzyme für die Polyadenylierung fördern.
Fazit:
Ja, unter diesen Bedingungen (mit einem IRES-Element und n1-PseudoUridin-Modifikationen) erscheint es logisch, dass die Re-Adenylierung der mRNA auch ohne eine intakte 5'-Cap-Struktur möglich wäre. Das IRES würde den Übersetzungsmechanismus unabhängig von der Cap-Struktur ermöglichen, während die PseudoUridin-Modifikation möglicherweise eine Umgehung der Deadenylierungsbarriere und die Rekrutierung von Poly(A)-Polymerasen (wie TENT4a/b) zur Re-Adenylierung fördert.
Diese Hypothese bietet eine interessante Perspektive auf die mRNA-Modifikationen und deren Einfluss auf den RNA-Stabilitätsmechanismus und die Translation unter abnormen Bedingungen.”