Ich will heute ein wenig weiter über die CD4-T-Helferzelle - die wohl am meisten unterschätzte und komplexeste T-Zelllinie - reden. Und versuchen, einige Fragen für mich und damit natürlich auch für jeden interessierten Leser, zu beantworten:
In meinem letzten Substack sprach ich allgemein über die CD4+ und CD8+. Dieses Substack wird auf diesem Artikel aufbauen.
Deutsch:
https://genervter.substack.com/p/in-der-hohle-des-lowen?utm_source=%2Fsaved&utm_medium=reader2
Englisch:
https://translate.google.com/translate?sl=de&tl=en&hl=de&u=https://genervter.substack.com/p/in-der-hohle-des-lowen?utm_source%3D%252Fsaved%26utm_medium%3Dreader2&client=webapp
A) Wie werden sie aktiviert?
B) Wie werden sie differenziert in → T-Helferzellen [Th(x)], follikuläre T-Helferzellen [regulatorische Helferzellen für die B-Zellen(Tfh)] und regulatorische T-Zellen (Treg)?
C) Welche Aufgaben übernehmen die T-Helferzellinien?
Wobei ich mich hier speziell auf die TH 17 -Helfer-Zelle und die TH1-Helferzelle fokussieren werde (aus gutem Grund).
Wer meine vorangegangen Substacks las, weiß, dass ich versuche, einen roten Faden aufzubauen, an dem ich mich lang hangle und all das, was ich zitiere, noch versuche, möglichst laienfreundlich (also sprich auch für mich) nach bestem Wissen und Gewissen und mit zehntausend Lernfragen an wesentlich klügere Köpfe gerichtet, zusammenzufassen.
Die CD4+-T-Helferzelle zählt zu den Lymphozyten.
Steigen wir an dieser Stelle also mit einem Auffrischungszitat ein.
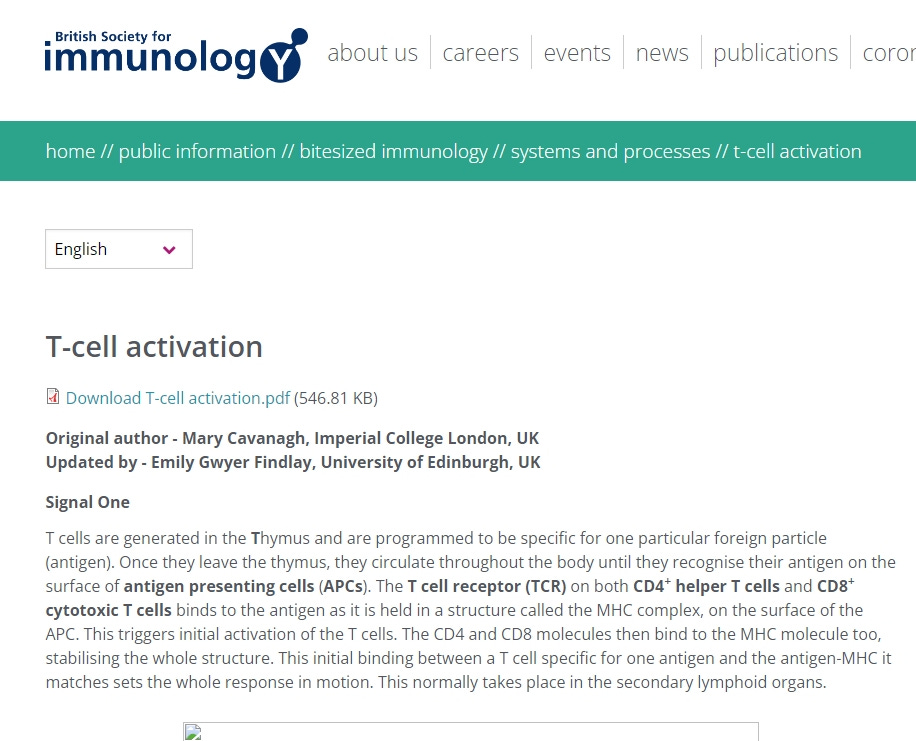
“T-Zellen werden in der Thymusdrüse gebildet und sind darauf programmiert, für ein bestimmtes Fremdpartikel (Antigen) spezifisch zu sein. Sobald sie den Thymus verlassen, zirkulieren sie im ganzen Körper, bis sie ihr Antigen auf der Oberfläche von Antigen-präsentierenden Zellen (APCs) erkennen. Der T-Zell-Rezeptor (TCR) sowohl auf den CD4+-Helfer-T-Zellen als auch auf den CD8+-zytotoxischen T-Zellen bindet an das Antigen, das sich in einer Struktur, dem so genannten MHC-Komplex, auf der Oberfläche der APC befindet. Dadurch wird die erste Aktivierung der T-Zellen ausgelöst. Die CD4- und CD8-Moleküle binden dann ebenfalls an das MHC-Molekül und stabilisieren die gesamte Struktur. Diese erste Bindung zwischen einer T-Zelle, die für ein Antigen spezifisch ist, und dem Antigen-MHC, zu dem sie passt, setzt die gesamte Reaktion in Gang. Diese findet normalerweise in den sekundären lymphatischen Organen statt.”
“Periphere lymphatische Organe, umfassen die Lymphknoten, die Milz und schleimhautassoziierte lymphatische Gewebe (BALT, GALT, MALT), in denen Immunreaktionen ausgelöst werden. In den zentralen lymphatischen Organen (Knochenmark und Thymus) findet dagegen die Entwicklung der Lymphocyten statt.”
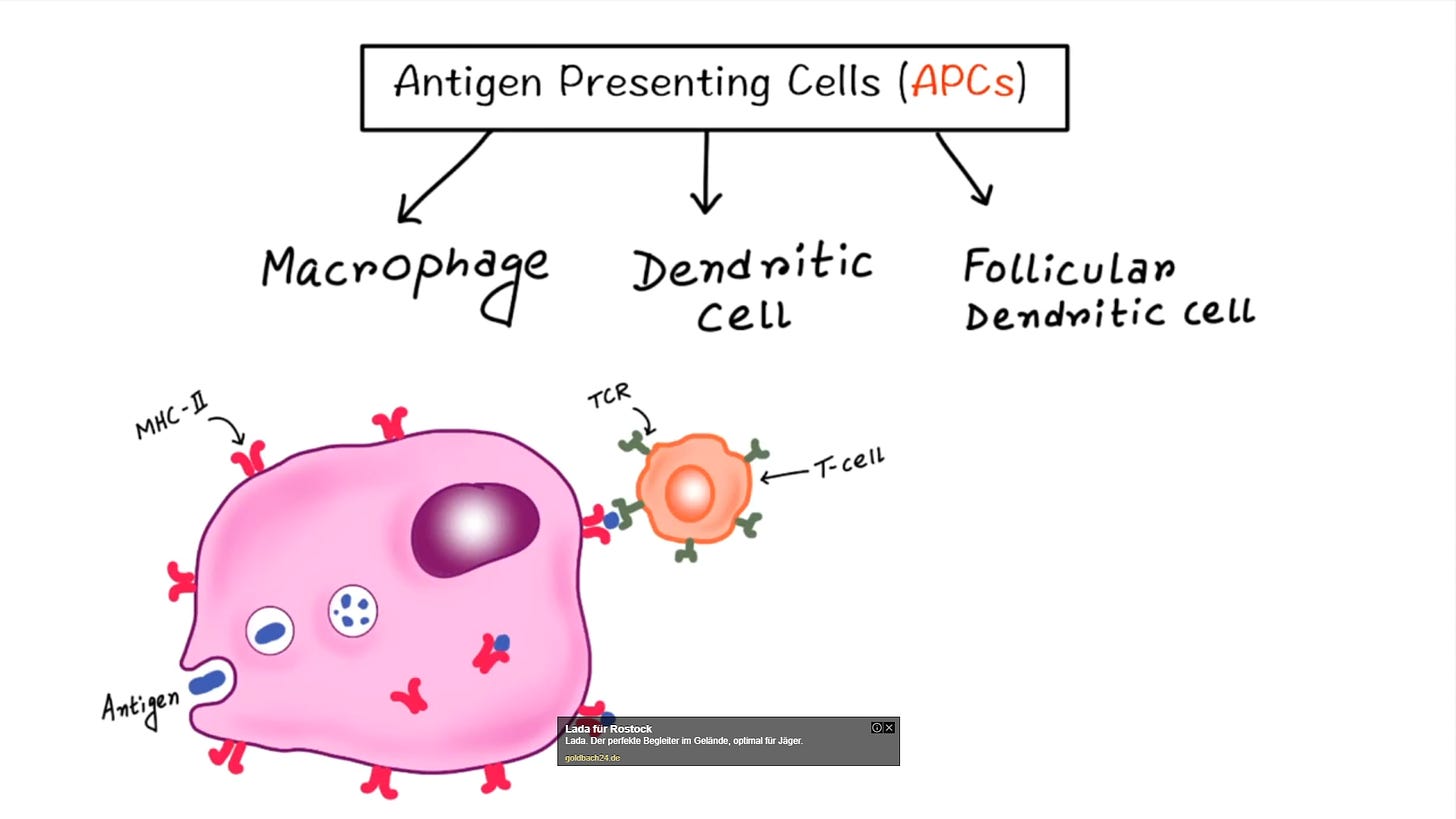
Und jetzt wird es kompliziert. Es ist unmöglich auch nur ansatzweise die CD4+ zu verstehen, wenn ich mich nicht zunächst mit der dendritischen Zelle auseinandersetze:
Es gib drei Arten von antigenpräsentierenden Zellen: Die Macrophage, die dendritische Zelle und die folikulär-dendritische Zelle.
Nachtrag 1 (Danke an Annelise Bocquet)
https://ncbi.nlm.nih.gov/pmc/articles/PMC6560339/
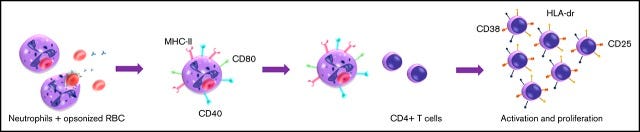
“In der vorliegenden Studie zeigen wir, dass menschliche Neutrophile nach der Phagozytose von Erythrozyten einen Antigen-präsentierenden Zellphänotyp (APC) erwerben. “
Darauf muss man erst mal kommen. Denn normalerweise - laut den meisten Papers - dienen Phagozyten “nur”™ der Regulierung zwischen nativem und innativem Immunsystem / nativem und adaptivem. (Ich persönlich bevorzuge den ersteren Begriff “innativ”.) Heißt also, es gäbe sogar 4 antigenpräsentierende Zelltypen im Thymus.
https://www.frontiersin.org/articles/10.3389/fimmu.2017.00319/full
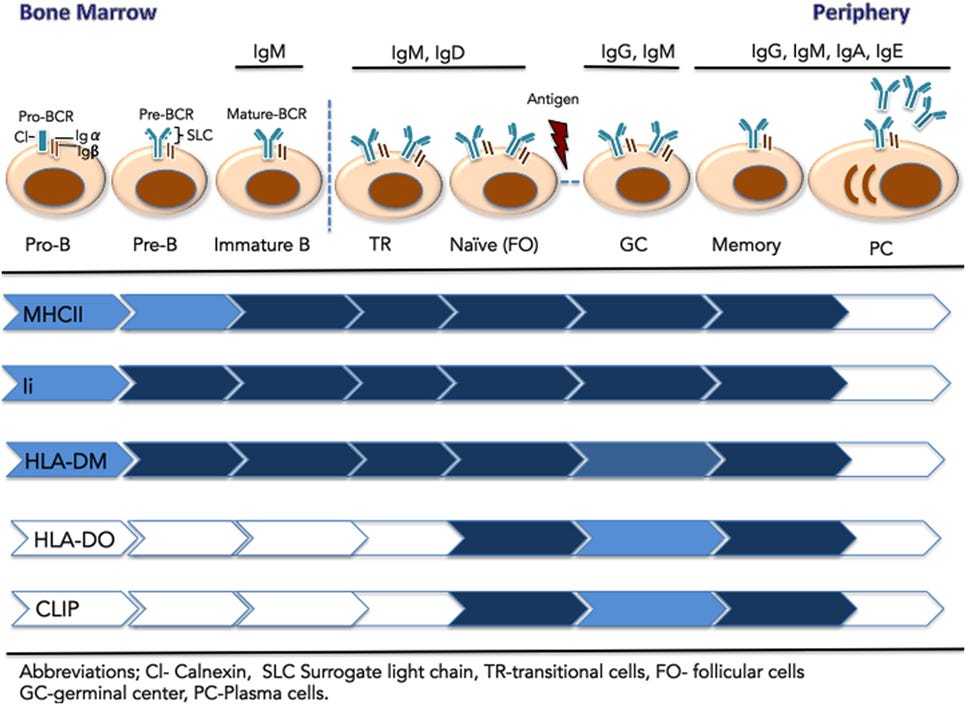
Natürlich spielen die MHC-ClassII-Antigen präsentierenden Zellen auch für die B-Zellen eine essentielle Rolle.
Ich werde mich in dieser Arbeit jedoch ausschließlich auf die DCs und die Interaktionen mit den CD4+ konzentrieren.
Nachtrag 1 ende
An dieser Stelle danke ich einer der cleversten Labormäuse, die auf diesem Planeten wandelt, für dieses großartige Paper. Danke an Jikky:
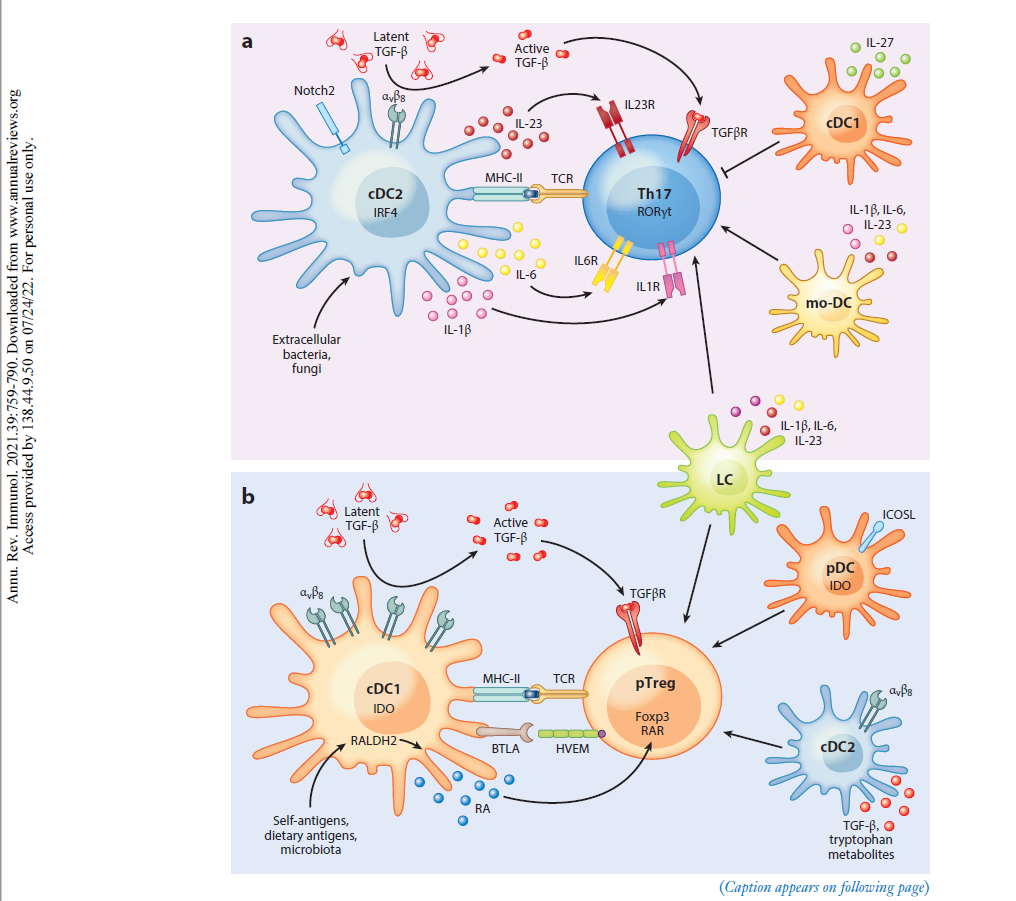
https://www.annualreviews.org/doi/10.1146/annurev-immunol-101819-025146
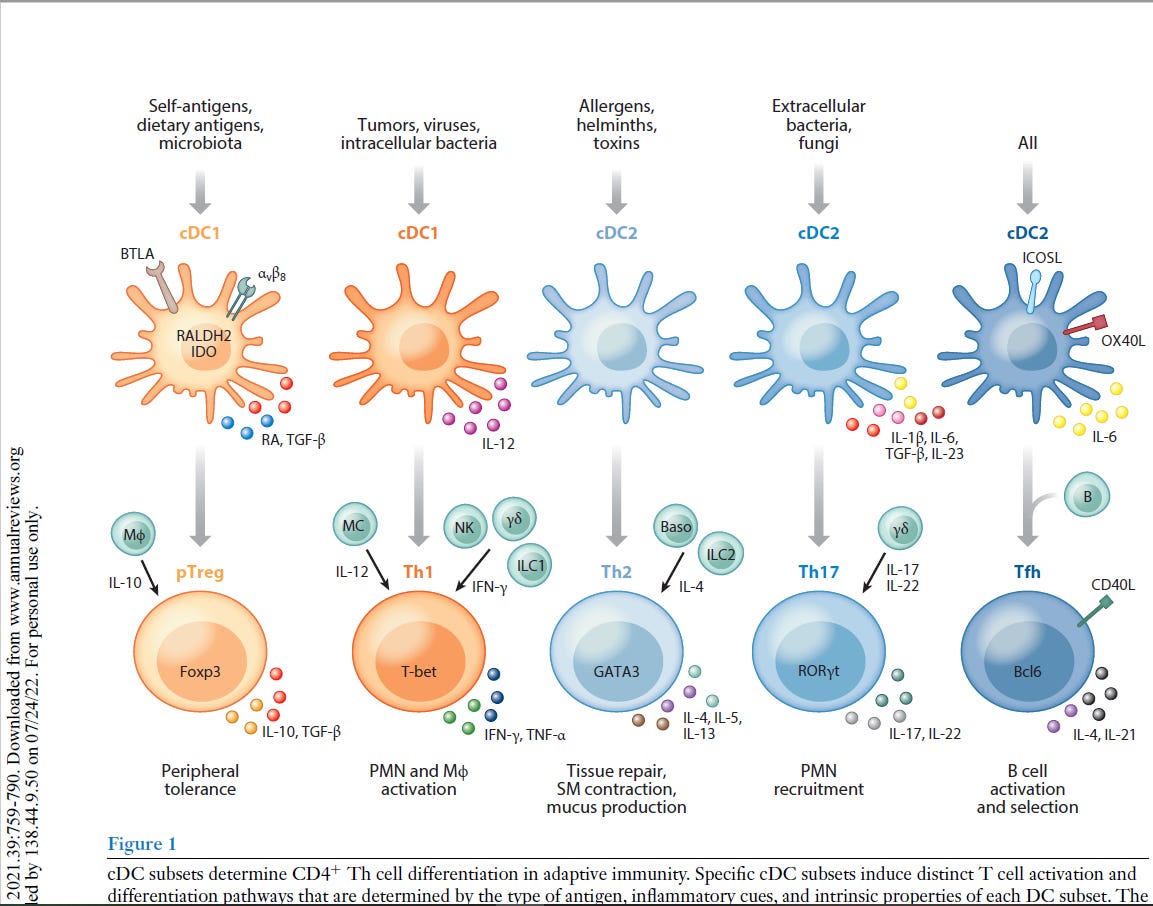
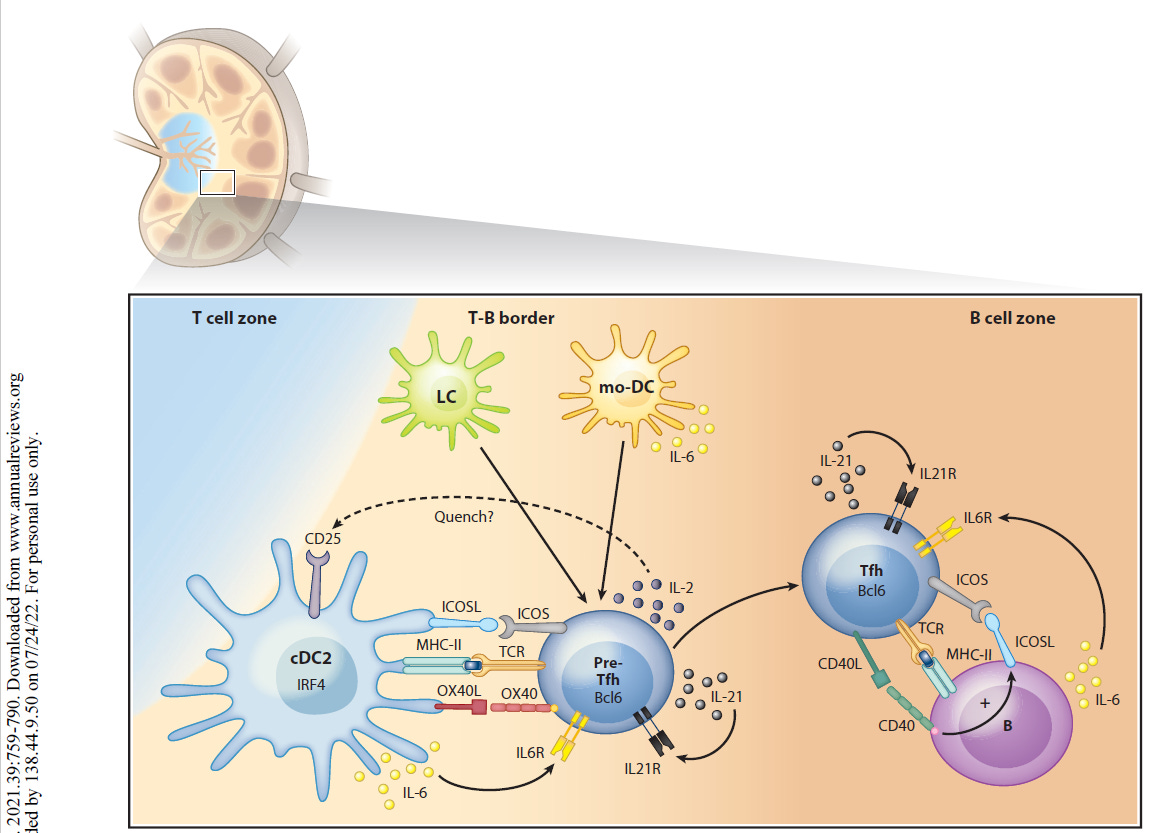
“Als professionelle Antigen-präsentierende Zellen des Immunsystems nehmen dendritische Zellen (DCs) die Mikroumgebung wahr und gestalten die darauf folgende adaptive Immunantwort. DCs können sowohl eine Immunaktivierung als auch eine Immuntoleranz auslösen, je nachdem, was an der Peripherie (Umgebung) geschieht. Neuere Arbeiten haben gezeigt, dass DCs mehrere phänotypisch (alle erkennbaren Eigenschaften) und funktionell heterogene Untergruppen umfassen, die die Differenzierung von T-Lymphozyten auf unterschiedliche Weise regulieren. Diese Übersicht fasst die Phänotypen, die Entwicklung, die Diversifizierung und die Funktion der DC-Untergruppen von Maus und Mensch zusammen. Wir konzentrieren uns auf die Fortschritte in unserem Verständnis, wie verschiedene DC-Untergruppen unterschiedliche CD4+ T-Helfer (Th)-Zelldifferenzierungsergebnisse regulieren, einschließlich Th1, Th2, Th17, T-follikuläre Helfer- und T-Regulatorzellen. Wir untersuchen die intrinsischen (inneren) Eigenschaften der DC-Untergruppe, die lokale Mikroumgebung des Gewebes und andere Immunzellen, die zusammen die Th-Zell-Differenzierung während der Homöostase und Entzündung bestimmen.”
“Es gibt mehrere Arten von DCs mit jeweils einzigartigen, aber auch überlappenden Funktionen und molekularen Mechanismen zur Induktion verschiedener Arten von CD4+ T-Zell-Reaktionen. Letztlich ist die Induktion des geeigneten T-Helferzell-Schicksals wichtig für die Rekrutierung und Aktivierung des effektivsten Immunwegs zur Bewältigung eines Insults. In diesem Bereich beginnen wir, diese verschiedenen molekularen Wege zu identifizieren, und erkennen gleichzeitig die Einheit einer Vielzahl phänotypisch unterschiedlicher DCs in verschiedenen Geweben während verschiedener Arten von Entzündungszuständen. cDC2 mit Entwicklungs- und Funktionsunterschieden wurden kürzlich erkannt, und es bleibt noch viel zu tun, um die maßgeschneiderte Natur ihrer unterschiedlichen Reaktionen zu verstehen. Bei chronischen Entzündungen entstehen mo-DCs und andere DCs mit sich überschneidenden Phänotypen, und wir beginnen zu verstehen, wie sie mit den cDCs verwandt sind und wie sie diese ergänzen. Die Art und Weise, wie verschiedene DCs einige CD4+ T-Zell-Zustände induzieren, ist klar, aber andere, wie die Th2-Differenzierung, bleiben unklar. “
Definieren wir zunächst dendritische Zelle:
dendritisch = baumartig/ verzweigt
Eine dendritische Zelle, kurz DC, ist eine antigenpräsentierende Zelle, die durch eine hohe Konzentration von MHC-Klasse-I / II-Molekülen und co-stimulatorischen Molekülen auf der Zelloberfläche besonders zur T-Zell-Aktivierung befähigt ist.
“Dendritische Zelle und ihre Oberflächenmerkmale (Cluster of Differentiation) kann man grundsätzlich zwei Formen von dendritischen Zellen unterscheiden myeloide dendritische Zellen (mDC) und plasmazytoide dendritische Zellen (pDC).
Plasmazytoide dendritische Zelle
Plasmazytoide dendritische Zellen, kurz pDCs, sind Zellen des unspezifischen Immunsystems, die im Blut zirkulieren und in peripheren lymphatischen Organen.”
Myeloide dendritische Zelle, kurz mDCs, sind eine heterogene Gruppe von Immunzellen, die Antigene aufnehmen, prozessieren und anschließend auf ihrer Zelloberfläche präsentieren”
https://www.researchgate.net/profile/Tewfik-Miloud/publication/51924651_Organ-Specific_Cellular_Requirements_for_In_Vivo_Dendritic_Cell_Generation/links/551093a30cf2a8dd79be681e/Organ-Specific-Cellular-Requirements-for-In-Vivo-Dendritic-Cell-Generation.pdf
“Die Gruppe der konventionellen Dendritischen Zellen wird anhand ihres Wanderungsverhaltens in migratorische und residente Dendritische Zellen unterteilt.”
(…)
“Die Typisierung Dendritischer Zellen gilt bei weitem als noch nicht abgeschlossen. Neue und verfeinerte Analysemethoden, wie z. B. Genexpressionsanalysen4), ermöglichen es, die einzelnen Gruppen Dendritischer Zellen anhand verschiedener Kriterien weiter zu unterteilen (Bar-On L et al., 2010; Lewis KL et al., 2011; Satpathy AT et al., 2012; Merad M et al., 2013). So wird auch die Zuordnung Dendritischer Zellen zu bestimmten Typen, bspw. der Langerhans-Zellen zu den konventionellen Dendritischen Zellen (s.o.), kritisch hinterfragt.”
Uff… Soviel dazu. Es gibt also sehr, sehr viele Untertypen der dendritischen Zelle, welche sich alle spzialisiert haben.
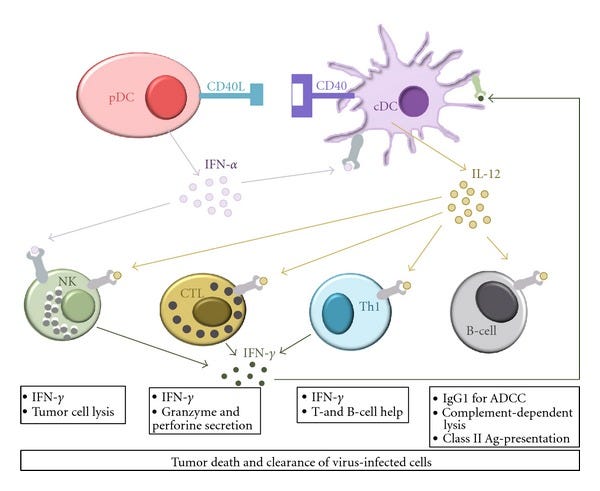
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3407661/
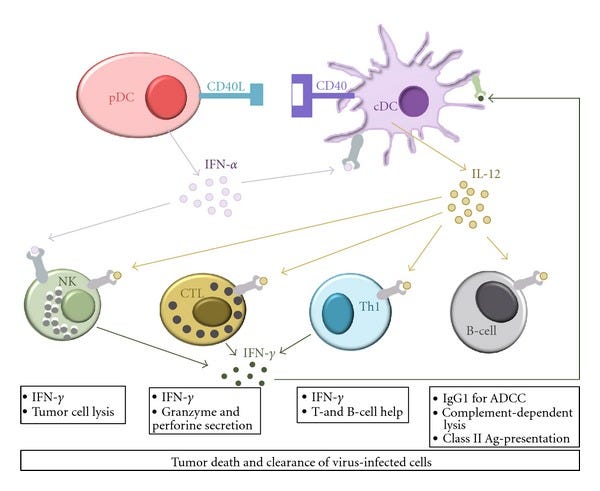
“Kooperatives Vorgehen verschiedener DC-Untergruppen bei der angeborenen und adaptiven Immunität zur Beseitigung von Tumoren und Virusinfektionen.”
(….)
“DCs entstehen aus CD34+ hämatopoetischen Stammzellen im Knochenmark und zirkulieren als Vorläuferzellen durch den Blutstrom zu den Zielgeweben. Darüber hinaus ist bekannt, dass bei physiologischem Stress auch Monozyten eine Quelle von DC-Vorläufern sind und sich in Gegenwart von GM-CSF und einer Reihe anderer Zytokine in unreife DCs differenzieren. Unreife DCs siedeln sich an Stellen an, an denen ein Antigen eindringen kann, und sind auf die Aufnahme und Verarbeitung von Antigenen spezialisiert. Sie erkennen die so genannten pathogen-assoziierten molekularen Muster (PAMPs), bei denen es sich um evolutionär konservierte Strukturen handelt, darunter mikrobielle Lipide, Kohlenhydrate, Nukleinsäuren und Zwischenprodukte der viralen Replikation (doppelsträngige (ds)RNA), über Mustererkennungsrezeptoren (PRRs). Es gibt mehrere Arten von PRRs, die an der angeborenen Erkennung von Krankheitserregern beteiligt sind, darunter Toll-like-Rezeptoren (TLRs), Nukleotid-bindende Oligomerisierungsdomänen-Rezeptoren (NOD-like-Rezeptoren), Interferon-(IFN-induzierte) dsRNA-aktivierte Proteinkinasen (PKR) und RIG-I-ähnliche Helikasen. Sobald DCs ein fremdes Antigen aufgenommen haben, durchlaufen sie einen hochgradig regulierten Reifungsprozess und wandeln sich in vollständig aktivierte Antigen-präsentierende DCs um, die in der Lage sind, wirksame Immunantworten hervorzurufen. Reife DCs exprimieren in hohem Maße verschiedene kostimulatorische Moleküle sowie Moleküle des Haupthistokompatibilitätskomplexes (MHC) auf ihrer Oberfläche. Die Reifung von DCs induziert auch die Produktion von Chemokinen, die naive und Gedächtnis-T-Zellen anlocken. Während des Reifungsprozesses verlassen die DCs das nicht-lymphoide Gewebe und wandern über die afferente Lymphe zu den lymphatischen Geweben. Anschließend aktivieren reife DCs (naive) T- und B-Lymphozyten, die das präsentierte Antigen als Peptid-MHC-Komplexe auf der Oberfläche der DC erkennen. Darüber hinaus ist aber auch eine positive Verstärkung der Antigenpräsentation durch Kostenstimulation und Sekretion verschiedener Zytokine von entscheidender Bedeutung, um eine angemessene Immunantwort auszulösen (vgl. 3.1).”
Ich denke, diese Erklärung hilft, zu begreifen, was die Aufgabe der unreifen und reifen dendritischen Zellen ist und wo sie freigesetzt werden.
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-021-01339-1
https://www.immunohorizons.org/content/2/6/185/tab-figures-data
https://academic.oup.com/oncolo/article/13/8/859/6397462?login=false
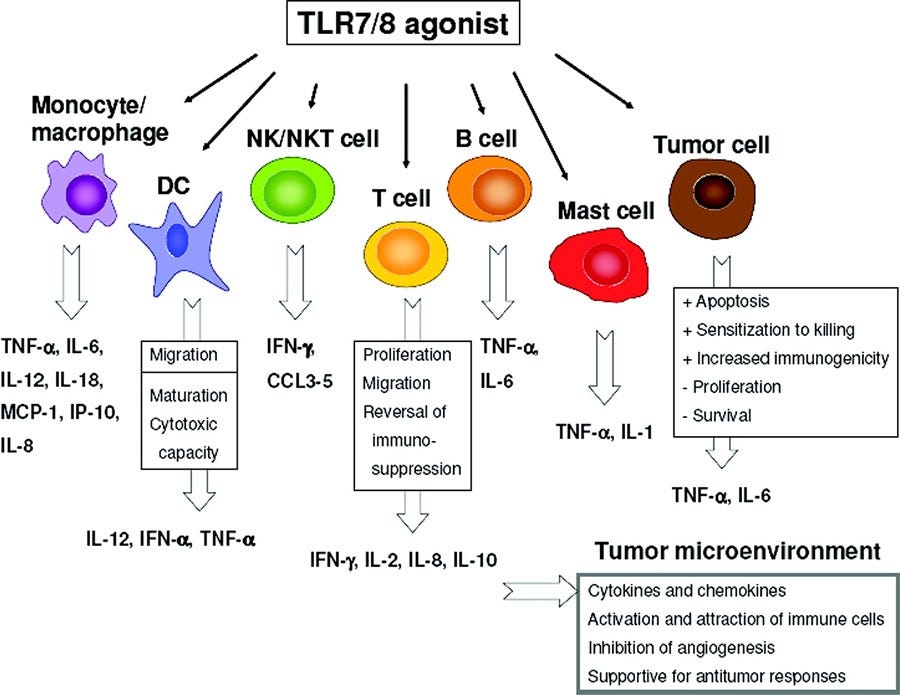
Eine kurze Randbmerkung, auf die ich vermutlich noch in einem weiteren Substack näher eingehen werde: Es ist bestimmt eine geniale Idee die Tol-Like-Rezeptoren 3, 7/8 zu manipulieren? → Hat garantiert vollste volle Erfolgsgeschichten zur Folge.
Bemerkenswert ist, dass auch die unterschiedlichen Arten der dendritischen Zellen zusammen arbeiten.
Der Aktivierungsprozess läuft also - ähnlich wie bei der CD8+ - durch die Bindung an einen dieser 3-Zelltypen, wobei ich mich in diesem Artikel ausschließlich mit der dendritischen Zelle beschäftigen werde. Und hier erst einmal einer der großen Unterschiede:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4860014/ ( https://www.nature.com/articles/nri.2015.10 )
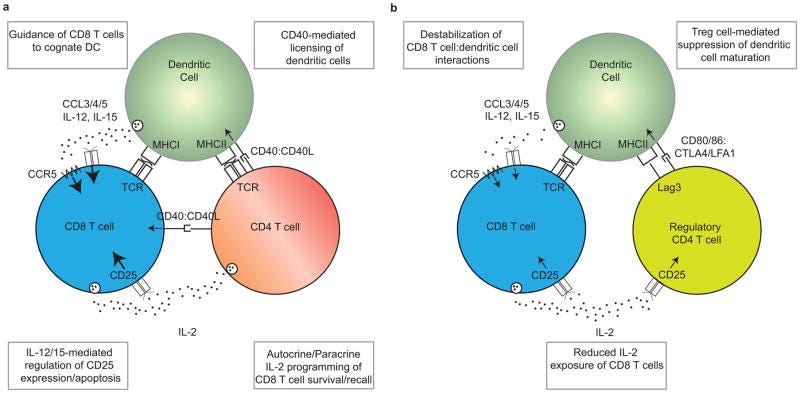
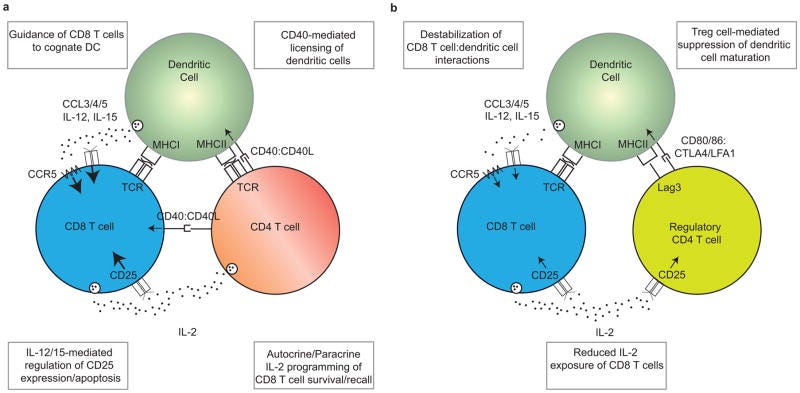
“Nach einer Immunisierung fördern CD4+ T-Zellen die Induktion einer robusten primären CD8+ T-Zell-Antwort durch zahlreiche Mechanismen, einschließlich der Lizenzierung von dendritischen Zellen (DCs) und der ‼Förderung der Interaktion‼ zwischen DCs und CD8+ T-Zellen.”
Ich werde dieses Paper an späterer Stelle weiter durchackern. Doch zunächst schauen wir uns noch weiter die dendritischen Zellen an und arbeiten etwas heraus:
doi.org/10.1111/j.1600-065X.2010.00913.x
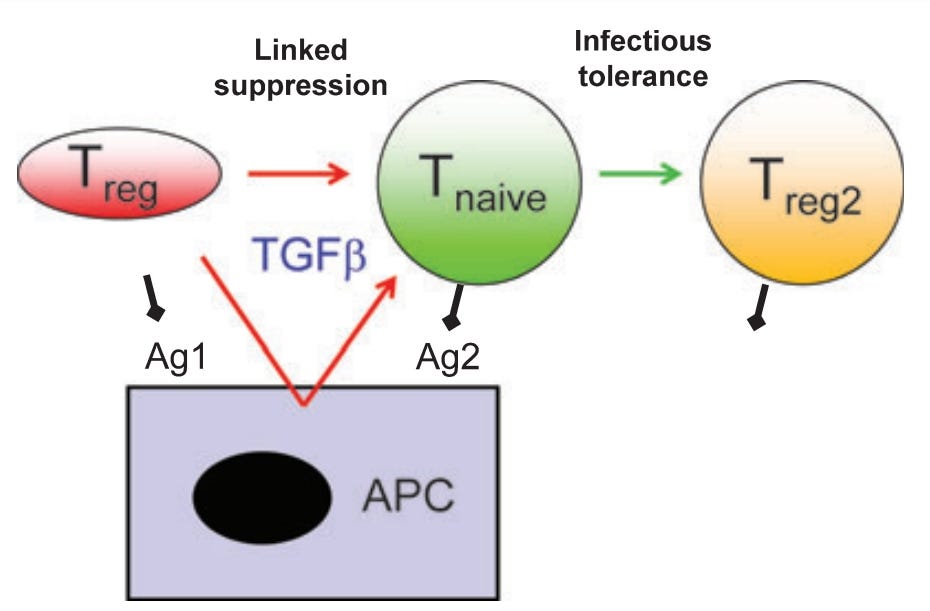
“Zur Erklärung der suppressiven Wirkung regulatorischer T-Zellen wurde eine Vielzahl unterschiedlicher molekularer Mechanismen vorgeschlagen, darunter die Produktion entzündungshemmender Zytokine, negativer kostimulatorischer Liganden (Als Ligand werden Stoffe bezeichnet, die einen Rezeptor besetzen und rezeptorvermittelt eine Wirkung auf die Zielzelle ausüben.), der durch Indoleamin-2,3-Dioxygenase vermittelte Tryptophanabbau, die CD73-vermittelte Adenosinbildung und die Herunterregulierung antigenpräsentierender Zellen. Bislang war unklar, wie wichtig jeder dieser verschiedenen Mechanismen sein könnte und wie sie koordiniert werden. In dieser Übersichtsarbeit wird die Hypothese untersucht, dass es die Interaktion zwischen regulatorischen T-Zellen und dendritischen Zellen ist, die eine lokale Mikroumgebung schafft, die arm an essenziellen Aminosäuren und reich an Adenosin ist und die zur Verstärkung einer Reihe verschiedener tolerogener Signale (Ein Tolerogen ist ein Antigen, das im Gegensatz zu einem Immunogen eine Toleranz in der Zelle auslöst. → keine Immunantwort) eine Toleranz im Organismus hervorruft, führt. Diese Signale werden schließlich alle durch die Inhibition von Rapamycin integriert, was die Induktion neuer, das Forkhead-Box-Protein 3 exprimierender, Tregs ermöglicht. Wenn dies zutrifft, bietet dies eine molekulare Erklärung für die in vivo auftretenden Phänomene der verbundenen Suppression und Infektionstoleranz.”
(…)
”In dieser Übersicht betrachten wir die Beweise dafür, dass DCs ein entscheidendes Glied in der Kette von Ereignissen sind, die Toleranz induzieren und aufrechterhalten, und bieten sowohl zelluläre als auch molekulare Erklärungen für die Phänomene der verknüpften Suppression und Infektionstoleranz.”
(…)
“Transformierender Wachstumsfaktor ß (TGFß) ist wichtig für die Induktion (Einleitung) von Toleranz und Tregs” → Das heißt: Dass auch die dendritischen Zellen für bestimmte Funktionen der regulatorischen-T-Zellen eine entscheidende Rolle spielen. Ich frage mich an dieser Stelle, ob irgendwer mal hingeschaut hat, wie diese nach der Transfektionsbrühe aussehen?
Was hier unglaublich kompliziert klingt, heißt eigentlich nichts weiter, als dass die Zytokine (in diesem Fall TGFß) beispielsweise, welches die dendritische Zelle ausschüttet (je nach Typ unterschiedliche Sets) maßgeblich daran beteiligt ist, welche Funktionen die regulatorischen T-Zellen (Treg) übernehmen. An dieser Stelle frage ich mich, ob die DCs auch die anderen T-Zell-Arten beeinflussen könnten?
Ich weiß, dass Einiges immer noch sehr abstrakt wirken muss, da ich noch nicht erklären kann, wie genau Zytokine entstehen und welche Prozesse dabei stattfinden. Doch so tief traue ich mich für diesen Artikel noch nicht ins Dunkel der Molekularbiologie vorzudringen.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3407661/
Und jetzt wird es wirklich spannend:
“3.1. 3-Signal-Theorie für T-Zell-Aktivierung
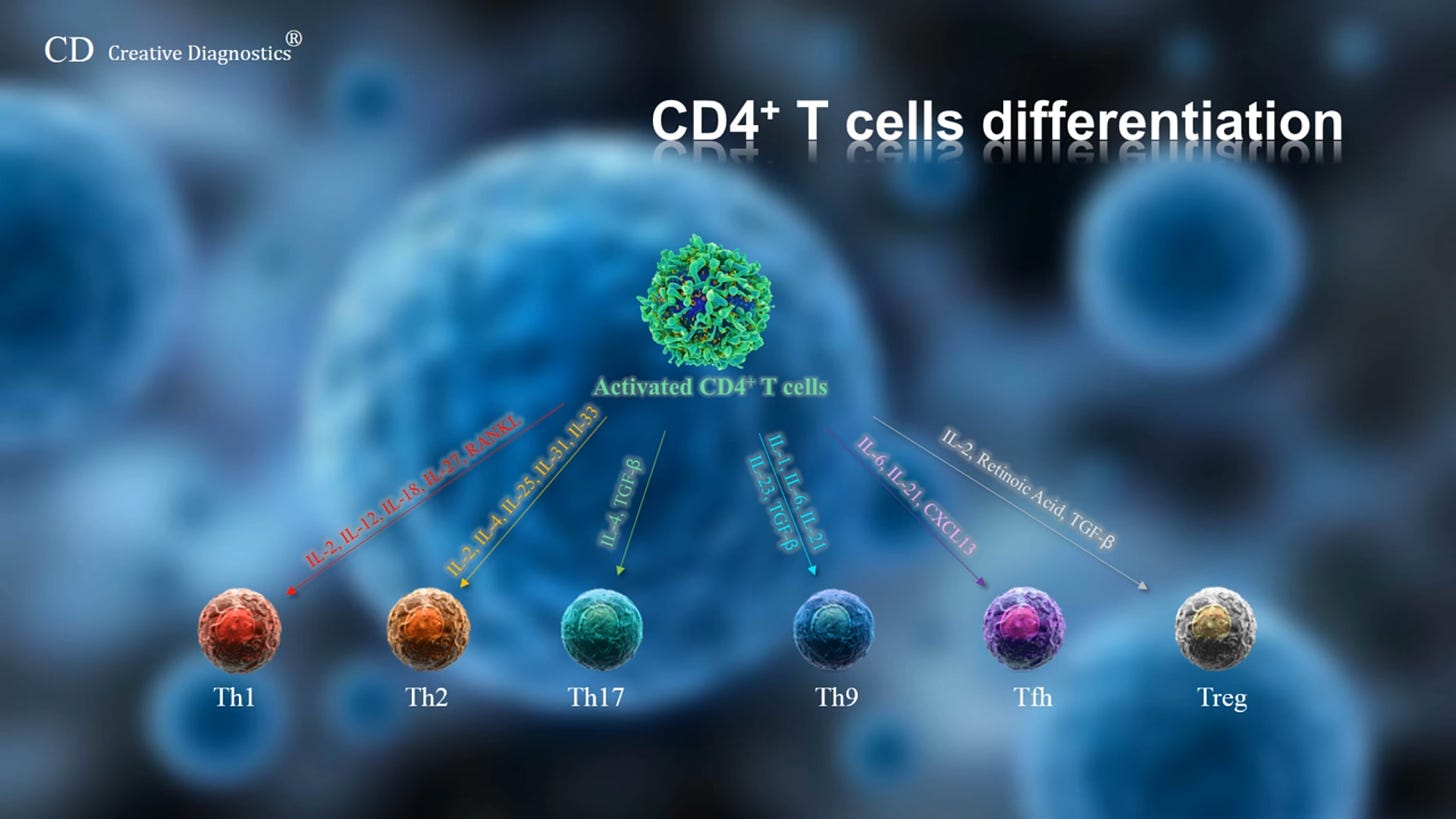
Therapeutische Impfstoffe zur Behandlung chronischer Infektionskrankheiten (z. B. Humanes Immundefizienz-Virus (HIV), Cytomegalie-Virus (CMV), Hepatitis-B-Virus (HBV) und Hepatitis-C-Virus (HCV)) oder zahlreicher Tumorarten (z. B. Melanom, Leukämie, Brust- und Prostatakrebs) zielen hauptsächlich darauf ab, eine antigenspezifische zellvermittelte Immunität zu induzieren, um infizierte Zellen zu beseitigen und Tumorzellen zu eliminieren. Jüngste Studien haben gezeigt, dass DCs eine entscheidende Rolle bei der Steuerung von Effektor-T-Zell-Reaktionen (anderer Term für CD4+T-Helferzelle) in Richtung einer Th1-, Th2-, Th17- oder regulatorischen T-Zell-Reaktion (Treg) spielen.“
Ich denke und hoffe, dass ich damit halbwegs verständlich die essentielle Rolle der DCs herausarbeiten konnte und werde nun final die CD4+-Zelltypdifferenzierung und die Bedeutung der Th beleuchten.
Steigen wir also mit der Differenzierung ein und lesen erst einmal das Abstrakt:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4860014/
“Nach einer Infektion differenzieren sich die T-Zellen zu einer heterogenen Population von Effektor-T-Zellen, die die Beseitigung von Krankheitserregern vermitteln können. Eine Untergruppe dieser Effektor-T-Zellen besitzt die Fähigkeit, langfristig zu überleben und zu Gedächtnis-T-Zellen zu reifen, die eine langfristige Immunität vermitteln können. Das Verständnis der Signale, die die Entwicklung von Gedächtnis-T-Zellen regulieren, ist entscheidend für die Entwicklung von Impfstoffen, die eine T-Zell-basierte Immunität hervorrufen können. CD4+ T-Zellen sind entscheidend für die Bildung von schützenden CD8+ T-Zellen nach einer Infektion oder Immunisierung. Bis vor kurzem waren jedoch die Mechanismen unklar, durch die CD4+ T-Zellen die Entwicklung von CD8+ T-Gedächtniszellen nach einer Infektion unterstützen. Im Folgenden werden neuere Studien vorgestellt, die einen Einblick in die vielschichtige Rolle von CD4+ T-Zellen bei der Regulierung der Differenzierung von CD8+ T-Gedächtniszellen geben.”
(…..)
”Die Hilfe von CD4+ T-Zellen ist erforderlich, damit DCs ihre Antigenpräsentations- und Co-Stimulationskapazität auf ein Niveau steigern können, das ausreicht, um eine robuste Effektor-CD8+ T-Zellen-Antwort auszulösen, wobei sowohl die CD4+ als auch die CD8+ T-Zellen das von demselben DC präsentierte Antigen erkennen. Diese Lizenzierung wird durch CD40:CD40L-Wechselwirkungen zwischen der DC und der kognitiven CD4+ T-Zelle vermittelt, die die funktionelle Reifung der DCs ermöglichen. Die lizenzierten DCs können anschließend mit CD8+ T-Zellen interagieren und eine starke Primärantwort auslösen. In einigen Fällen können CD40:CD40L-Interaktionen auch direkt zwischen CD8+ T-Zellen und CD4+ T-Zellen stattfinden.”
Lizenziert bedeutet in dem Fall, dass die DCs die CD8+-zytotoxischen T-Zellen anlocken. Habt ihr aufgepasst?: Die CD4+ wird durch die DCs aktiviert aber aktiviert auch zeitgleich wiederum die DCs zum Anlocken und Antigenpräsentieren der CD8. Zeitgleich entscheidet die DC über Interleukine, welche CD4+-Effektorzellsubart daraus entsteht.
Hier also die Zytokininteraktionen (ich denke nicht, dass das alle sein werden, aber es ist eine sehr schöne Übersicht, um zu verstehen, wie Signalwege, Interleukine, Tumorwachstumsfaktoren und Interferone zusammen arbeiten):
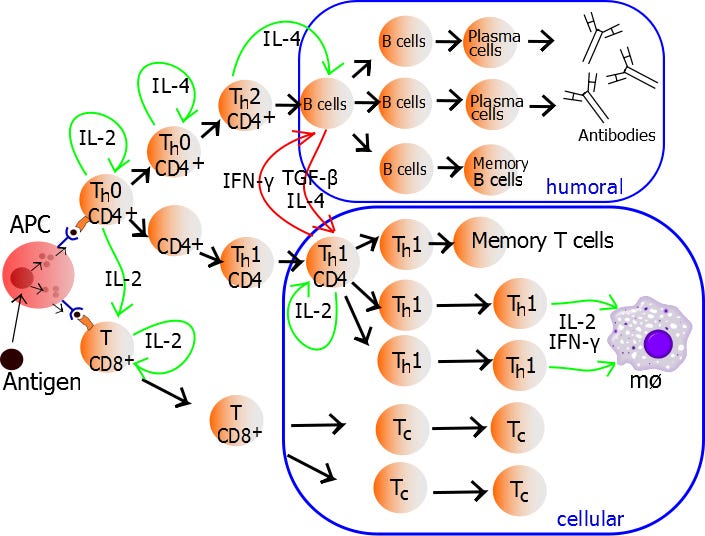
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3050492/
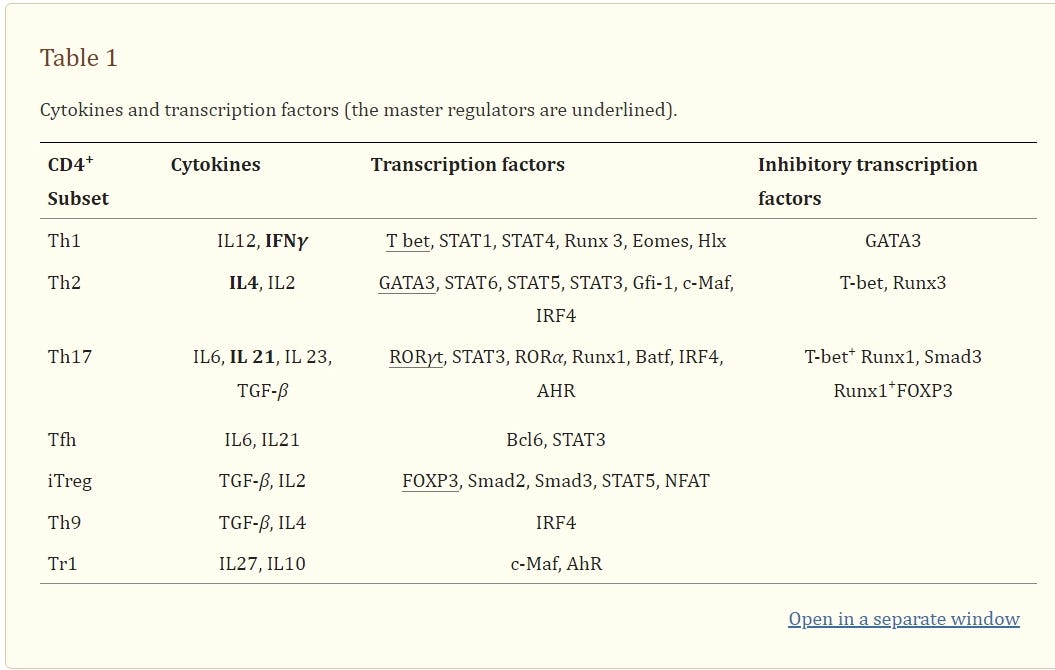
Für die unter euch, die es ganz genau wissen wollen, sind in dieser Studie die einzelnen Interaktionen der DC-Phenotypen, die bekannt sind, aufgelistet und wo sie zu finden sind. Schaut euch bitte genaustens die TH 17 an und merkt euch: IL6, 21, 23, TGF-beta.
Fassen wir bis hier hin kurz zusammen:
Ich hoffe, ihr konntet bis hierhin mit mir zusammen einige Schlussfolgerungen ziehen und Punkt A) und B) damit schon mal als abgearbeitet betrachten.
Die erste Schlussfolgerung lautet also, dass es um feinste Gleichgewichte zwischen den einzelnen dendritischen Zelltypen geht, die sich gegenseitig beeinflussen.
Die zweite ist, dass die CD4-T-Zellspezialisierung exakt von diesen Gleichgewichten abhängt.
Die dritte lautet, dass sämtliche anschließend freigesetzten Zytokine in einem bestimmten Gleichgewicht freigesetzt werden, welches an das jeweilige Pathogen genaustens in Feintuning angepasst ist.
Und die vierte Schlussfolgerung wäre, dass der Ort und die Art der Antigenpräsentation essentiell für die Immunantwort sind.
Vielen dank für den wundervollen Austausch an dieser Stelle an “DorlessCarp”:
”So habe ich es gelesen, und die Auswirkungen können pleiotrop sein. Immunologisch gesehen geht es um die Aufteilung der Reaktion und Untergruppen je nach Grad und Art der Antigenpräsentation und dem Ort, z. B. dem Darm. Es geht um ein Gleichgewicht zwischen zu vielen Tregs, die ein Tumorwachstum ermöglichen, und zu wenigen, die eine Autoimmunität zulassen. Das derzeitige mRNA-Vax-Regime ist viel zu sehr auf Letzteres ausgerichtet, während die Tumorkontrollpunkte auch über Dutzende andere Wege gestört werden.”
Uff. Das Gröbste ist geschafft und braucht nur einen kontinuierlichen Feinschliff, um noch besser verstanden zu werden.
Tauchen wir dazu noch kurz in die Welt der T-Helferzellen mit zwei Fallbeispielen ein: Der TH17 und der TH1.
“Die TH17-Zellen, kurz TH17, sind eine spezielle Subgruppe der T-Helfer-Zellen. Sie spielen eine wichtige Rolle bei der Aktivierung von neutrophilen Granulozyten und sind nach dem von ihnen produzierten Interleukin-17 (IL-17) benannt.
2 Differenzierung
TH17-Zellen entwickeln sich unter dem Einfluss verschiedener Zytokine aus naiven T-Zellen. Für die Differenzierung und das Überleben der Zellen sind u.a. TGF-β, Interleukin-6 (IL-6), Interleukin-21 (IL-21) und Interleukin-23 (IL-23) verantwortlich. Sie werden von antigenpräsentierenden Zellen nach Antigenkontakt produziert. Interferon-gamma (IFNγ) und Interleukin-4 (IL-4) hemmen hingegen die Differenzierung zu TH17-Zellen. In den genetischen Prozess der Differenzierung von TH17-Tellen sind die Transkriptionsfaktoren Stat3, RORγ und RORα involviert.”
Nachtrag 2 (danke auch hier an Annelise Bocquet, denn das ist wirklich irre.)
Und es gibt ein weiteres Problem bei der TH17:
https://cancerci.biomedcentral.com/articles/10.1186/s12935-022-02528-8
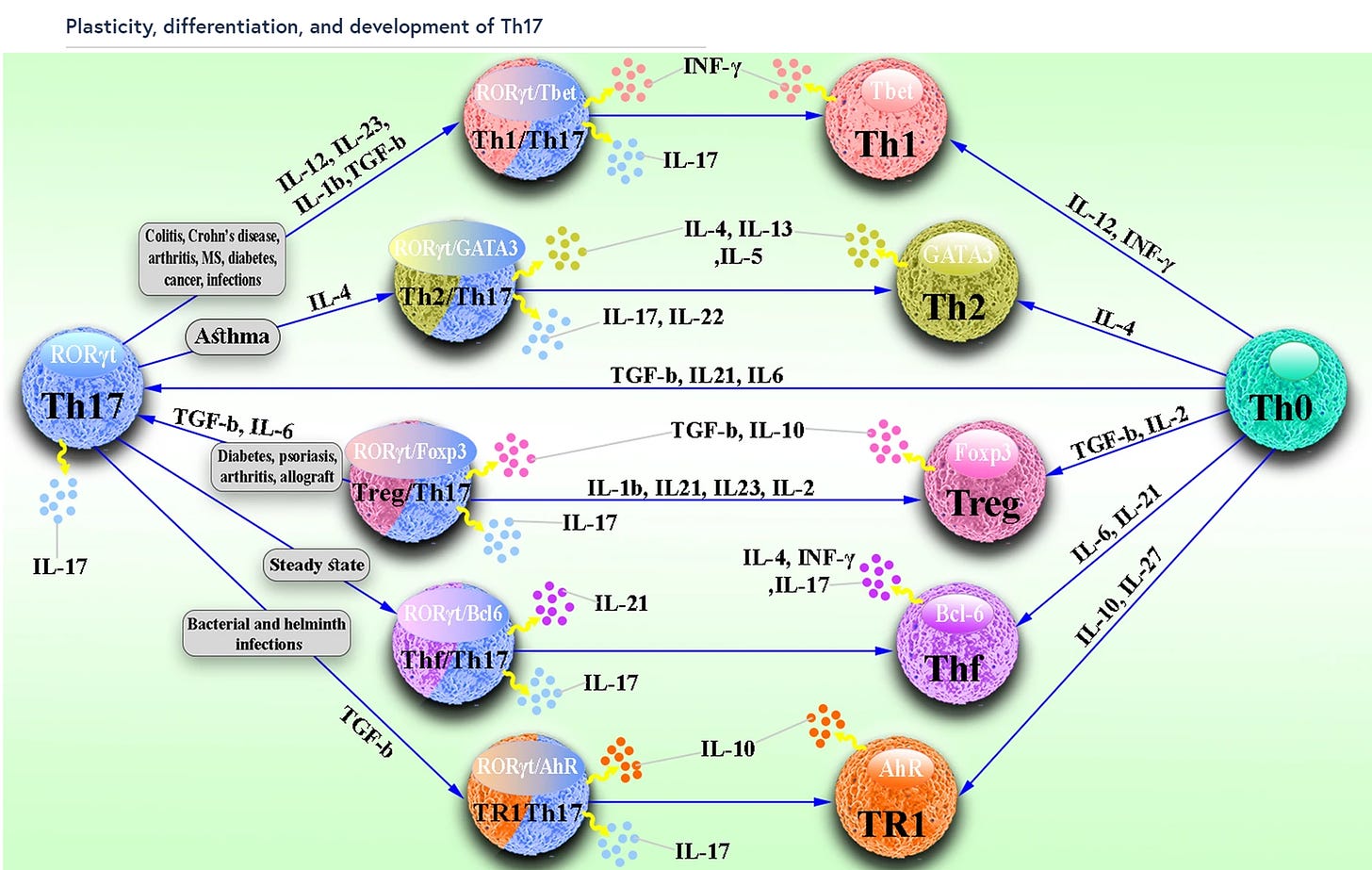
”Plastizität, Differenzierung und Entwicklung von Th17
Im Gegensatz zu Th2- und Th1-Zellen, die relativ stabil sind, weisen Th17-Zellen ein sehr hohes Maß an Plastizität auf. Wie in Abb. 1 dargestellt, haben Studien gezeigt, dass sich Th17-Zellen hauptsächlich in TFH-, Th2-, TR1-, Treg- und Th1-Zellen umwandeln können, die je nach Umgebungsbedingungen eine Vielzahl von unterschiedlichen Funktionen aufweisen. Th17-Zellen können immunhemmende Funktionen übernehmen, indem sie sich bei Infektionen und Autoimmunerkrankungen in TR1- oder Treg-Zellen verwandeln. Th17-Zellen wandeln sich im Dauerzustand auch in TFH-Zellen um und sind an der Förderung IgA-produzierender B-Zellen beteiligt. Am wichtigsten ist jedoch, dass Th17-Zellen eine pathogene Aktivität erlangen, indem sie sich bei Asthma in Th2-Zellen und bei Infektionen, Krebs und Autoimmunerkrankungen in Th1-Zellen verwandeln.”
Nachtrag 2 ende
“Die TH1-Zellen sind eine Subgruppe der T-Helfer-Zellen. Sie übernehmen Funktionen bei der Regulation von entzündlichen Prozessen sowie in der Abwehr von Erregern, insbesondere Bakterien. TH1-Zellen interagieren v.a. mit antigenpräsentierenden Makrophagen.”
http://frontiersin.org/articles/10.3389/fimmu.2022.941009/full
Dazu mal ein kurzer Zwischenruf: Wie war das gleich wieder mit den bakterienähnlichen Codes, die im Spike gefunden wurden?
https://ncbi.nlm.nih.gov/pmc/articles/PMC8447452/
“Obwohl noch keine Daten über die Produktion von IL-17 und IL-21 nach der BNT162b2-Impfung vorliegen, scheint die Produktion von IL-17 und IL-21 eine wichtige Rolle beim impfstoffinduzierten immunologischen Schutz zu spielen. Es ist bemerkenswert, dass Zytokine wie IL-4, IL-17 und IL-21 mit der Aktivierung von Keimzentren in Verbindung gebracht werden und bei Autoimmunerkrankungen wie Pemphigus, insbesondere in der Anfangsphase, eine wichtige Rolle spielen. Eine starke Antikörperreaktion nach einer Impfung erfordert jedoch in der Regel mehr als fünf Tage. Bei Patienten, die mit BNT162b1 geimpft wurden, treten spezifische Antikörper 14-21 Tage später auf. Es ist sehr wahrscheinlich, dass bei unserer Patientin die Impfung mit BNT162b2 ihre T/B-Zell-Antwort verstärkte, was zu dem unerwünschten Ausbruch von Pemphigus führte. Eine genetische Anfälligkeit kann eine solche Nebenwirkung begünstigen.”
https://pnas.org/doi/suppl/10.1073/pnas.2203659119/suppl_file/pnas.2203659119.sd01.xlsx
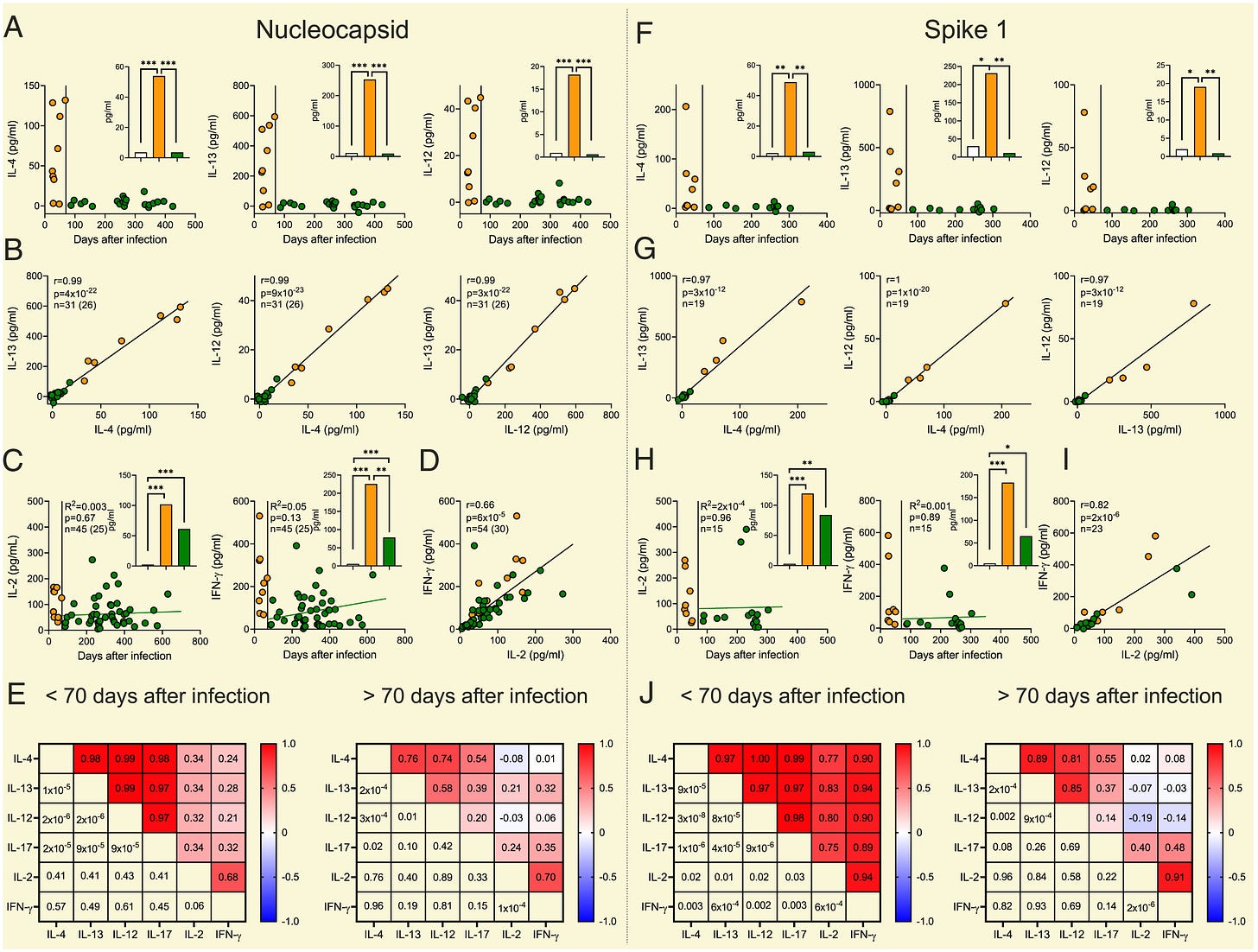
“Multimere Peptide, die das gesamte Nukleokapsidprotein umspannen, lösten ex vivo bis ∼70 Tage nach bestätigter Infektion eine auffallend synchrone Bildung von Interleukin (IL)-4, IL-12, IL-13 und IL-17 aus, danach war diese Reaktivität nicht mehr induzierbar. Im Gegensatz dazu blieben die Nukleokapsid-induzierten IL-2- und Interferon-γ-Spiegel 3 bis 21 Monate nach der Infektion stabil und hoch korreliert. Eine ähnliche Zytokindynamik wurde bei ungeimpften, rekonvaleszenten (erholenden) Patienten beobachtet, wobei Vollblutproben mit Peptiden stimuliert wurden, die den N-terminalen Teil des Spike-1-Proteins abdecken. Diese Ergebnisse zeigen zwei Phasen der T-Zell-Reaktivität nach einer natürlichen COVID-19-Infektion: eine frühe, synchrone Reaktion, die auf eine vorübergehende Präsenz multipolarer, antigenspezifischer T-Helferzellen (TH) hinweist, gefolgt von einer ebenso synchronen und dauerhaften TH1-ähnlichen Reaktivität, die ein lang anhaltendes T-Zell-Gedächtnis widerspiegelt.”
Schaut euch einfach mal dieses perfekt orchestrierte Gebilde an, um zu verstehen, wieso insbesondere die CD4+ und natürlich auch die CD8+ ein solches Wunderwerk sind, dass es mir gerade den Atem raubt, wenn ich darüber nachdenke und es mich bei dem Gedanken stocksauer macht, das Pfeyzer und modRNA dieses Gotteswerk zerklumpt haben.
“Unerwarteterweise wurde IL-12, ein prototypischer Mediator der Immunität vom TH1-Typ, durch NC- und S1-Peptide synchron mit IL-4, IL-13 und IL-17 in den ersten Monaten nach der Infektion induziert (Abb. 1).”
Siehe meine Frage nach den Bakteriencodes)
Sorry, Patty-Sue, keine Gedächtnis-T-Zellen für dich.
Dafür gibt es nutzlose und vermutlich von ADCC (einem Syndrom, welches die B-Zellen erschöpft und ineffektive Antikörper formen lässt) betroffene und somit kurzlebige B-Gedächtniszellen:
https://www.medrxiv.org/content/10.1101/2022.07.05.22277189v1.full-text
“Es wird allgemein angenommen, dass sich antigenspezifische IgG4-Antikörperreaktionen als Reaktion auf eine Th2-vermittelte B-Zellen-Aktivierung oder als Folge einer chronischen Antigenexposition entwickeln. Parasiteninfektionen oder allergische Antigene sind dafür bekannt, dass sie CD4+Th2-Zellen zur Produktion von Zytokinen wie IL-4, IL-5 oder IL-13 anregen können, während die meisten Virusinfektionen Th1-gerichtete zelluläre Reaktionen fördern. Erste Berichte über die zelluläre Reaktion auf den mRNA-Impfstoffkandidaten BNT162b1 deuteten auf ein Th1-Profil in der klinischen Studie der Phase I/II hin, und auch in anderen Berichten wurde keine Th2-lastige Immunantwort festgestellt. Vor diesem Hintergrund scheinen Th2-Reaktionen eine eher unwahrscheinliche Erklärung für die robuste und konsistente IgG4-Reaktion zu sein, die wir spät nach der zweiten und kurz nach der dritten Immunisierung beobachtet haben. Die Stimulierung von PBMCs von Geimpften, die hohe oder niedrige IgG4-Werte aufwiesen, mit Spike-T-Zell-Epitopen ergab keine signifikanten Unterschiede in der Häufigkeit von S-spezifischen Th-Zellen und deutete eher auf eine Th1-lastige CD4-Antwort hin, basierend auf den beobachteten Häufigkeiten von IFNγ- und IL-4-produzierenden Zellen. Im Gegensatz dazu wurde in drainierenden Lymphknoten mittels Feinnadelaspirationsbiopsie eine robuste und anhaltende Reaktion der follikulären T-Helferzellen bis zu sechs Monate nach der mRNA-Impfung festgestellt, was mit einer lang anhaltenden GC(Granolozyten)-Reaktion in Einklang steht. Der Grund für diese Beobachtung muss noch geklärt werden, aber eine längere Präsenz der Impfstoff-mRNA oder des Antigens in den Lymphknoten könnte eine mögliche Erklärung sein.”
Woran merkt ihr, dass die Autoren hier etwas schwurbeln und euch eiskalt ins Gesicht lügen?! Oh, BNT162b1?! → Doof für die Autoren, dass BNT162b‼1‼ NIE die Testphase verlassen hat. Übrigens noch ne kleine Quizfrage: Wie soll etwas festgestellt werden, wenn jede weitere Untersuchung bewusst vermieden wird?!
Wer noch mehr über die IGG4-Antwort lesen mag und was das eigentlich für ein kranker Scheiß ist:
Hier gibt es ein wundervolles Substack, welches dies noch näher beleuchtet.
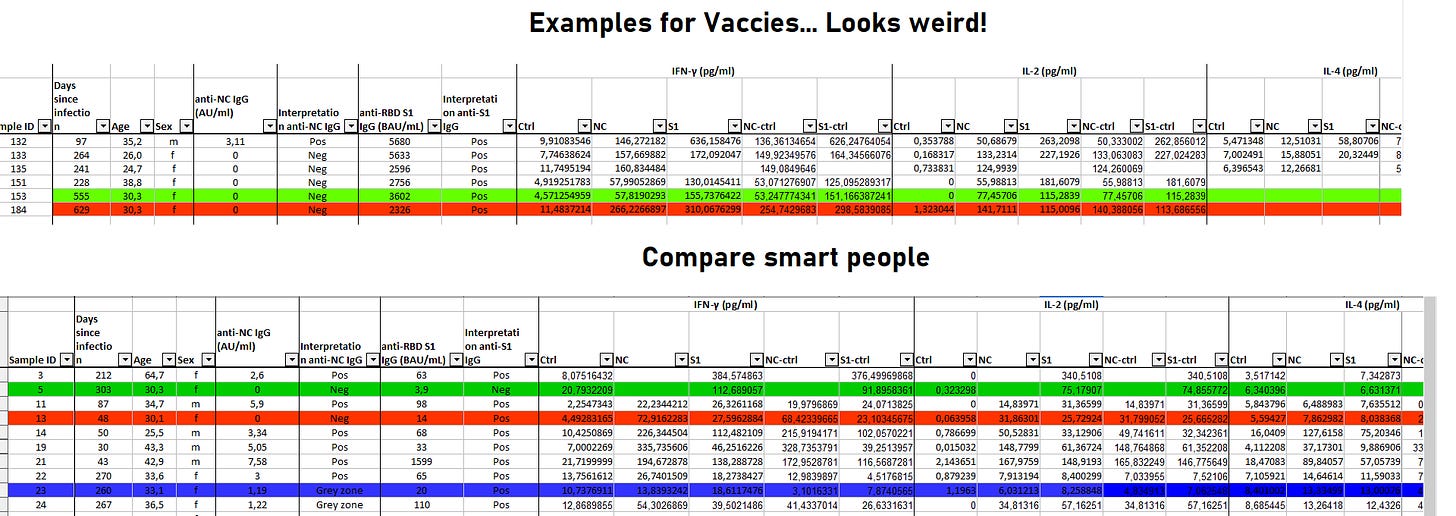
Schauen wir uns das Datenset der von mir oben zitierten Studie zur TH1 und T-Gedächtniszellbildung an (welche übrigens auch noch nach >21 Monaten eine kreuzreaktive breite Immunantwort liefert):
https://pnas.org/doi/suppl/10.1073/pnas.2203659119/suppl_file/pnas.2203659119.sd01.xlsx
Das nennt man UNgleichgewicht! Ich habe bewusst eine bestimmte Altersklasse zum Vergleich markiert. Und die Unterschiede sollten wohl jedem ins Auge stechen, was die Zytokine angeht, die sich normalisieren sollten, insbesondere, wenn man sich die Zeit bei den Geimpften ansieht, die seit der Infektion verstrichen ist.
Was auch immer da abgeht, wird die gebildeten T-Gedächtniszellen der Impflinge garantiert früher oder später zerschrotten.
Was könnte schon schiefgehen?
https://www.frontiersin.org/articles/10.3389/fimmu.2020.02025/full
“Während der Schwangerschaft sorgen verschiedene Immuneffektoren und Moleküle, die an der Immun-Mikroumgebung beteiligt sind, für eine spezifische mütterliche Toleranz gegenüber dem semi-allogenen Fötus. Die durch die Trophoblastenantigene aktivierten mütterlichen Immuneffektoren, wie T-Helfer- (Th), zytotoxische (Tc), regulatorische (Treg) und B-Zellen, sind an der Regulierung der adaptiven Immunität beteiligt. Die Erkennung aktiver Signale durch die T-Zell-Rezeptoren stimuliert die Differenzierung naiver CD3+CD4+ T-Zellen in spezifische T-Zell-Untergruppen, wie Th1, Th2, Th9, Th17, Th22 und follikuläre Th-Zellen (Tfh). Jede dieser Untergruppen spielt in der menschlichen Schwangerschaft eine wichtige und unterschiedliche Rolle. Die Th1-Immunität, die durch immun-inflammatorische Reaktionen gekennzeichnet ist, wird während der Periimplantationszeit dominant, und die "kontrollierte" Th1-Immunität nützt den eindringenden Trophoblasten eher, als dass sie ihnen schadet. Kurz nach der Einnistung der Plazenta verlagert sich die frühe entzündliche Th1-Immunität zu den entzündungshemmenden Th2-Immunantworten. Die vorherrschende Th2-Immunität, die die Th1-Immunität an der Einnistungsstelle der Plazenta überlagert, schützt den Fötus, indem sie die Th1-Immunität ausgleicht und die fetale und plazentale Entwicklung unterstützt. Darüber hinaus regulieren Treg- und Th9-Zellen lokale entzündliche Immunreaktionen, die für den Fötus potenziell schädlich sind. Th17-Zellen induzieren während der Schwangerschaft eine schützende Immunität gegen extrazelluläre Mikroben. Eine übermäßige Th17-Immunität kann jedoch zu einer unkontrollierten Neutrophileninfiltration an der mütterlich-fötalen Schnittstelle führen. Auch andere Th-Zell-Untergruppen wie die Tfh-Zellen tragen zur Schwangerschaft bei, indem sie eine günstige humorale Immunität während der Schwangerschaft aufbauen. Eine Dysregulation der Th-Zell-Immunität während der Schwangerschaft kann jedoch zu geburtshilflichen Komplikationen wie wiederkehrenden Schwangerschaftsverlusten (RPL) und Präeklampsie (PE) führen. Mit dieser Übersichtsarbeit möchten wir einen umfassenden Überblick über CD4+ Th-Zell-Untergruppen, einschließlich Th1, Th2, Th9, Th17, Th22 und Tfh-Zellen, in der menschlichen Schwangerschaft geben, indem wir ihre Rolle in normalen und pathologischen Schwangerschaften untersuchen.”
Nachtrag 3 (26.07.2022)
Schauen wir uns doch mal an einem Fallbeispiel an, was so bei einer TH17 - über die falschen Signalwege egtriggert - schieflaufen kann:
(Ihr erinnert euch?: Manipuliere niemals die Signalwege)
Deutsch:
https://genervter.substack.com/p/wir-mussen-redenwillst-du-wirklich
Englisch:
https://www.pnas.org/doi/10.1073/pnas.2116256118
“Multiple Sklerose (MS) ist eine immunvermittelte Krankheit, die sich auf das zentrale Nervensystem auswirkt. Ein Mausmodell für MS, die experimentelle autoimmune Enzephalomyelitis (EAE), wird verwendet, um den Mechanismus der MS-Pathogenese zu ermitteln. STAT5 ist ein Transkriptionsfaktor, der eine entscheidende Rolle bei der Vermittlung zellulärer Reaktionen nach Zytokinstimulation spielt. Aktivierte STAT5-Proteine durchlaufen eine funktionelle Dimerisierung und Tetramerisierung. Diese Studie zeigt, dass STAT5-Tetramere die Pathogenese von EAE fördern. STAT5-Tetramere erleichtern die Interaktionen zwischen Th17-Zellen und von Monozyten stammenden Zellen (MDCs) in der Hirnhaut. Darüber hinaus fördert die durch STAT5-Tetramer vermittelte Expression des Chemokins CCL17 in MDCs die Extravasation von Th17-Zellen in die Hirnhäute. In unserer Studie wurde also ein GM-CSF-STAT5-Tetramer-CCL17-Signalweg identifiziert, der therapeutisch genutzt werden kann.”
https://www.sciencedirect.com/science/article/pii/S016557282100312X
“Akute neurologische Defizite im Zusammenhang mit einer kürzlich erfolgten Verabreichung des mRNA-Impfstoffs COVID-19 könnten eine neu auftretende Multiple Sklerose darstellen.”
Nachtrag 3 ende
Nachtrag 4 (Wenn man denkt, man hat schon alles auf dem Schirm, sollte man nur mal eine Biologin fragen. Danke erneut an Annelise)
Na dann haue ich doch direkt mal noch ein paar Beweise dafür hinter her:
Ungleichgewicht der TH17 und TH1
https://arthritis-research.biomedcentral.com/articles/10.1186/ar2964
“Lupus erythematodes, kurz LE, ist eine systemische Autoimmunerkrankung, die zusammen mit der systemischen Sklerodermie und der Dermatomyositis zu den Kollagenosen gehört. Typisch für diese Erkrankungen sind hohe Titer an Autoantikörpern, die sich gegen körpereigene Organe richten.”
https://pubmed.ncbi.nlm.nih.gov/24331831/
“Ein Befall der Gebärmuttermuskulatur heißt Adenomyose (Adenomyosis uteri). Eine Ausbreitung auf die Scheidenwand und den Darm (Dickdarm) kommt vor. Eine Endometriose kann auch in der Lunge oder in anderen inneren Organen wie z. B. im Gehirn vorkommen, auch wenn dies selten der Fall ist (extragenitale Endometriose). Eine Endometriose kann eine Ursache von Unfruchtbarkeit bei Frauen sein.”
Ich muss noch einmal fragen: Was könnte schon schiefgehen?
https://www.frontiersin.org/articles/10.3389/fimmu.2020.01027/full
“T-Zell-Stoffwechsel: Eine neue Perspektive auf das Ungleichgewicht zwischen Th17- und Treg-Zellen bei systemischem Lupus erythematodes”
Was könnte bei feinsten Chemischen Gleichgewichten in den Interleukinen, welche sowohl die TH1, als auch die TH17 und zeitgleich auch noch die regulatorischen T-Zellen beeinflussen, schief gehen? Insbesondere wenn sich auch noch zeitgleich die TH1 und TH17 sowie die regulatorischen und die TH17 beeinflussen?
https://www.nature.com/articles/cddis201795/metrics
”IL-27 löst die Produktion von IL-10 in Th17-Zellen über ein c-Maf/RORγt/Blimp-1-Signal aus und fördert das Fortschreiten der Endometriose”
Wie man also unschwer erkennen kann: Kann man da mal eben mit ner Handgranate reinfeuern. Wird schon nicht so schlimm werden… Naja. Vllt. ja doch. Aber das sind dann, uhm, wie nannten unsere deutschen Medien es?:
https://www.swr.de/swraktuell/rheinland-pfalz/nocebo-effekt-nach-corona-impfung-100.html
Ach ja… Nocebo Effekt.
Nachtrag 4 ende
Nachtrag 5 (27.07.2022)
https://jneuroinflammation.biomedcentral.com/articles/10.1186/s12974-019-1579-0
“Der Toll-like-Rezeptor 4 (TLR4) ist dafür bekannt, dass er das angeborene Immunsystem aktiviert. Er wird jedoch auch in adaptiven Immunzellen wie CD4+ T-Helfer 17 (Th17)-Zellen stark exprimiert, die eine Schlüsselrolle bei der Pathologie der Multiplen Sklerose (MS) spielen. Die Funktion und der Steuerungsmechanismus von TLR4 in Th17 bleiben jedoch unklar.”
“Toll-like-Rezeptoren (TLRs) sind wichtige Proteine des angeborenen Immunsystems, die eine entscheidende Rolle bei der Auslösung von Entzündungsreaktionen und der Förderung adaptiver Immunreaktionen spielen, die für die Erkennung und Beseitigung eindringender Krankheitserreger verantwortlich sind. Eine unangemessene Aktivierung von TLRs, wie z. B. TLR4, und nachgeschalteter Signalwege wurde mit bestimmten Autoimmunkrankheiten, darunter MS, in Verbindung gebracht. TLR4 ist bei Patienten mit MS und im Rückenmark von EAE-Mäusen hochreguliert. In vivo verschlimmert die Behandlung mit TLR4-Liganden, wie z. B. LPS, die EAE, während eine gezielte Unterbrechung von TLR4 die EAE verhindert. Die Aktivierung von TLR4 führt zu hohen Konzentrationen von proinflammatorischen Zytokinen wie IL-1β und IL-6, die die Differenzierung von Th17-Zellen einleiten. Aktivierte Th17-Zellen können IL-17 und GM-CSF sezernieren, was zu einer Autoimmunität des ZNS mit Demyelinisierung führt. Neben angeborenen Immunzellen wie Mikroglia und Makrophagen wird TLR4 auch in einer Vielzahl von adaptiven Immunzellen einschließlich CD4+ T-Zellen exprimiert, und zwar in noch höherem Maße in Th17-Zellen als in Th1- und Th2-Zellen. Über die Rolle der TLR4-Aktivierung bei Th17 ist jedoch wenig bekannt.”
Und hier kommt die ultimative Verbindung zwischen Toll-Like-Rezeptoren, miRNA und der TH17. Wieso sagten wir “Verschwörungsspinner”, dass es schief gehen wird?
Vllt. weil wir davon ausgehen, dass Zelle die kleinste lebendige Einheit ist, die man sich vorstellen muss: Es finden komplexe Interaktionen und Kommunikationen innerhalb statt um eine möglichst stabile und langlebige Selbsterhaltung zu garantieren.
Als Reminder zu miRNAs:
Deutsch:
Englisch
te.goog/p/uber-die-dummste-idee-die-man-haben?utm_source=/saved&utm_medium=reader2&_x_tr_sl=de&_x_tr_tl=en&_x_tr_hl=de&_x_tr_pto=wapp
Nachtrag 5 ende (vielen Dank für diesen großartigen Fund, lieber Maples).
Erinnert ihr euch an den Nobrainer, der euch in mindestens jeder zweiten Studie begegnen wird, die behauptet, die T-Zellen würden eine “robuste Antwort”™ nach dem Transfektionsschuss liefern?: Sie machen es an der Interferon-Gamma-Antwort fest (Vielen lieben Dank an Manu für diesen großartigen Hinweis.):
”CD4-positive TH1-Zellen bilden Interferon-gamma nach Kontakt mit einem Makrophagen oder einer anderen antigenpräsentierenden Zelle, welche Antigene phagozytiert hat. Es ist das Marker-Zytokin dieser Zellklasse. Weitere, zur Interferon-γ-Produktion fähige Zellen sind CD8-positive T-Zellen, dendritische Zellen sowie natürliche Killerzellen (NK-Zellen).”
Was haben wir heute über Dendritische Zellen gelernt? Sie spielen eine Schlüsselrolle. Aber auch hier gibt es Ausnahmeregeln. Und erst recht gibt es soviele Regeln dabei, welche Zytokine freigesetzt werden, dass es ein absoluter Nobrainer ist, der jedoch immer wieder als Argument für eine robuste T-Zellantwort vorangeschickt wird, das Ganze an der Interferon-Antwort festmachen zu wollen. Ganz zu Anfang dieses Artikels zitierte ich:
"Darüber hinaus ist aber auch eine positive Verstärkung der Antigenpräsentation durch Kostenstimulation und Sekretion verschiedener Zytokine von entscheidender Bedeutung, um eine angemessene Immunantwort auszulösen (vgl. 3.1).”
https://www.frontiersin.org/articles/10.3389/fimmu.2019.00778/full
”Quellen von Typ-I-Interferonen in der Infektionsimmunität: Plasmazytoide dendritische Zellen haben nicht immer das Sagen”
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6290111/
"Die Bewertung antigenspezifischer T-Zell-Reaktionen auf virale Antigene wird häufig an IFN-γ-sezernierenden Zellen durchgeführt. T-Zellen sind jedoch in der Lage, viele weitere Funktionen als nur IFN-γ zu produzieren, von denen einige, wie z. B. Perforin, mit dem Immunschutz bei der Elite der HIV-1-Kontrollpersonen in Verbindung gebracht werden. Wir haben das Ausmaß der fehlenden T-Zell-Funktionen untersucht, wenn die IFN-γ-Sekretion als Surrogatmarker für die weitere Bewertung der T-Zell-Funktionen verwendet wird. Intrazelluläre Zytokinfärbung und Durchflusszytometrie wurden verwendet, um periphere mononukleäre Blutzellen (PBMCs) von 31 HIV-infizierten ART-naiven Personen auf das Ausmaß zu untersuchen, in dem gated (gesteuerte) CD4+ und CD8+ IFN-γ produzierende und nicht produzierende T-Zellen auch IL-2, Perforin und TNF-α sezernierten. In ähnlicher Weise wurde das Ausmaß fehlender virusspezifischer Antworten in IFN-γ-ELISpot-Assay-negativen T-Zellen von 5 nicht HIV-1-infizierten Personen bewertet. Zellen von HIV-infizierten Personen wurden mit gepoolten Peptiden der Konsensusgruppe M (Con M) stimuliert; Zellen von gesunden Personen wurden mit gepoolten Adenoviruspeptiden (Ad) stimuliert. Insgesamt war die Häufigkeit der virusspezifischen IFN-γ-sezernierenden CD4+- und CD8+-Zellen gering. Der Anteil der IFN-γ-negativen CD4+, die IL-2, Perforin oder TNF-α zu Con M exprimieren, war signifikant höher (5 von 7 Funktionsprofilen) als der entsprechende IFN-γ-positive CD4+ (0 von 7) T-Zell-Phänotyp, p = 0,02; Fisher's Exact Test. Ebenso war der Anteil der CD8+ T-Zellen, die andere Funktionen ausübten, bei 4 der 7 IFN-γ-negativen CD8+ T-Zellen signifikant höher. Insbesondere das neu stimulierte Perforin, das als Perforin-Koexpression mit IL-2 oder TNF-α identifiziert wurde, war bei IFN-γ-negativen CD8+ T-Zellen signifikant höher als bei den positiven CD8+ T-Zellen. Bei der Verwendung von SEB wurden geringere Reaktionen bei IFN-γ-positiven Zellen vor allem mit CD4+ als mit CD8+ T-Zellen in Verbindung gebracht. Diese Ergebnisse legen nahe, dass in Studien zur Bewertung der Immunogenität als Reaktion auf virale HIV- und Adenovirus-Antigene nicht nur die T-Zell-Ansprechbarkeit der IFN-γ-produzierenden Zellen bewertet werden sollte, sondern auch die der T-Zellen, die kein IFN-γ exprimieren."
Die perfekte Furinspaltstelle und 4 HIV-Insertionen? → Was könnte das mit dieser Studie gemein haben?
Summar summarum könnte man (danke an Maples für dieses recht passende Bild) die dendritischen Zellen als die Späher einer Armee aus Immunreaktionen betrachten. Während die CD4+-T-Zellen wohl die Hauptarmee wären, die man in verschiedene Klassen differenzieren kann, wie beispielsweise Gebirgsjäger, Marine, etc.
An dieser Stelle noch eine wichtige Randbemerkung: Das eine geht in den transfizierten Zellen direkt ab. Dort haben wir all die verrückten Sachen mit dem m1Pseudouridin. Das andere, wovon ich hier gerade berichte, geschieht intrazellulär. D.h. die Kommunikation und Reaktionen finden außerhalb der transfizierten Zelle als Reaktion auf die Transfektion statt.
Ich verabschiede mich heute mit einem systemischen Review von Margaret A. Liu zum Thema mRNA - und plasmide DNA-Impfstoffe, welches ihr euch wirklich in Ruhe durchlesen und euch jedes Wort auf der Zunge zergehen lassen solltet.
https://www.mdpi.com/2076-393X/7/2/37/html
NARFige Grüße, euer Genervter (3Annoyed).
Danksagung:
(Vielen Dank an all die klugen Köpfe, die mit mir zusammen das hier aufarbeiten und für die endlos vielen Hinweise. Ein besonderer Dank an Tatiana, Annelise und Maples. Vielen Dank an Cyrus Kim für sein Review.♥♥♥)