Downstream Teil 2
Meine erste Folie, mit der ich zufrieden bin und die mir zeitgleich Angst macht.
2. Die Membran oder: “Houston, we might have a problem”
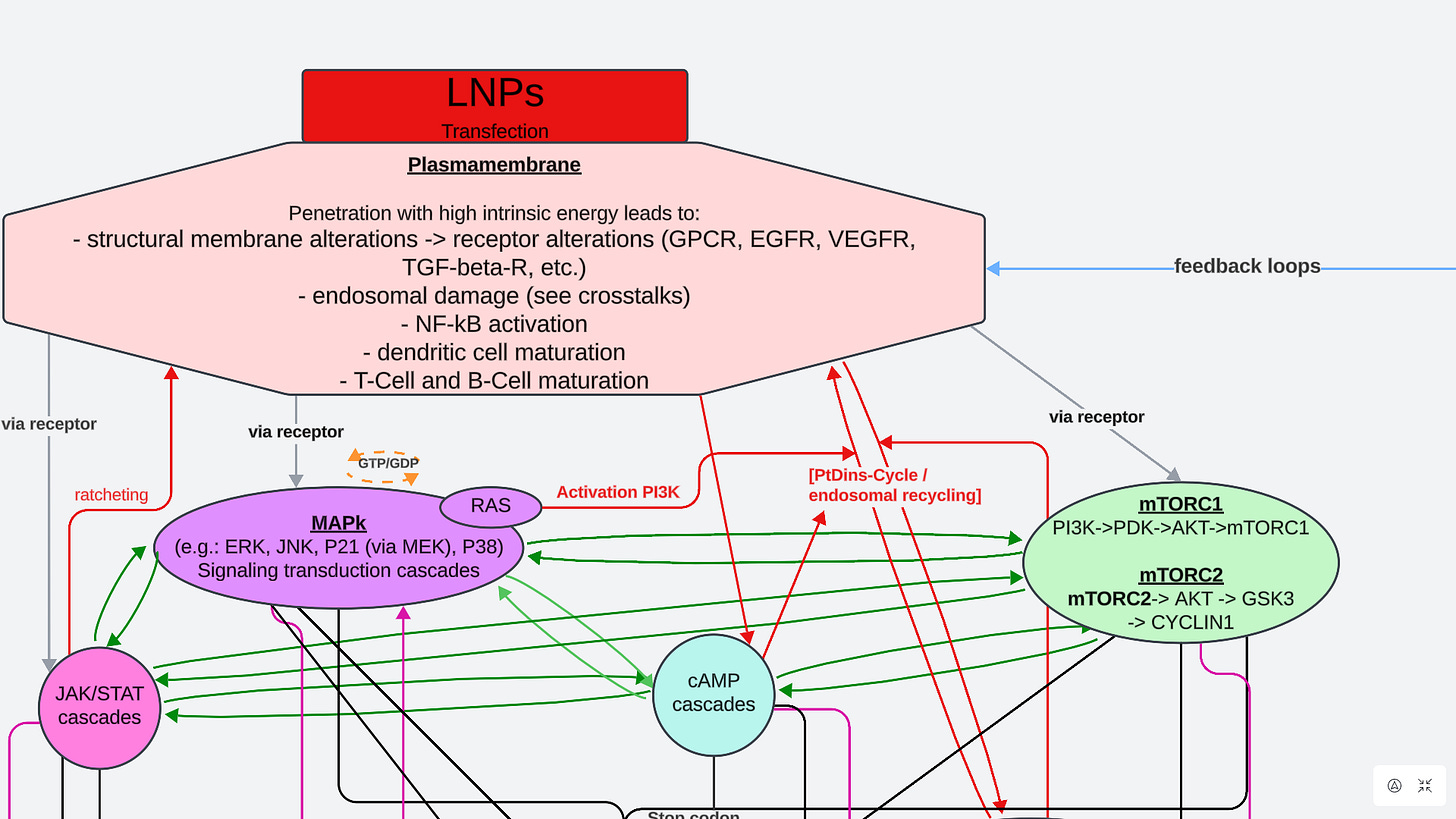
Wir befinden uns also schon in den Vollen meiner Folie und betrachten zunächst diese Schritte: “Plasmamembran und Signaltransduktion”, “was verstehen wir unter Signaltransduktion” und “Signaltransduktion und die Rolle im PtdIns-Zyklus”. Bevor jemand fragt, wo ich diese Folie her habe: Die habe ich selbst mit der Freeversion Lucidcharts entwickelt und bin dabei der Literatur gefolgt, bei der ich mir sicher war, wie ich die Pfeile zu setzen habe. Die Doppelpfeile stehen für eine komplexe Check and Balance-Interaktion.
“Leider” muss ich euch an dieser Stelle durch einen weiteren Höllenritt quälen, da die Membranstruktur und Komplexität notwendiges Basisverständnis ist.
Die phospholipide Doppelschicht und die MAPkkk/kk/k mit Augenmerk auf RAS(k/n/h)
Wow. Es ist schon wieder ganz schön lange her, dass ich mein letztes Substack schrieb. Darin behandelte ich ja die Micro-RNAs, mögliche Alterationen und die Unbekannten, die N1-methyliertes Pseudouridin (m1ψ) darauf haben kann. Seitdem beschäftigte ich mich jedoch noch intensiver mit den Signalkaskaden, da diese meiner Meinung nach sträflich unterschätz…
Im Hinterkopf behalten:
Liposome unterscheiden sich also in erster Linie einzig und allein durch die Komplexität ihrer Struktur und Ladung. Nicht aber vom Basisprinzip, was sie mit einer Zelle anrichten (siehe auch Lipid Nanoparticles─From Liposomes to mRNA Vaccine Delivery, a Landscape of Research Diversity and Advancement)
Ich werde also hier mit euch das Problem der Transfektion auf diesem Level kurz mit 2 systemischen Reviews durchackern. Auch wenn beide etwas “eingestaubt sind” und von den selben Autoren stammen, sind sie - meiner bescheidenen “Nichtwissenschaftler”™-Meinung nach - ein fundamentales Gerüst, auf dass man aufbauen kann, da wir alle dort beschriebenen Phänomene 1:1 live beobachten.
Cationic liposomal lipids: From gene carriers to cell signaling
“In kürzlich erschienenen Berichten wurden die Transfektionseigenschaften von kationischen Lipid/DNA-Komplexen und ihr intrazellulärer Transport beschrieben. Sie verdeutlichen wiederum den Mangel an Informationen über die Interaktion des Trägers selbst mit Zellkomponenten und seine Auswirkungen auf die Zellphysiologie. Immer mehr Berichte deuten jedoch darauf hin, dass kationische Liposome stark mit der Zelloberfläche interagieren und die Zusammensetzung und Ladung der Membran verändern.” (siehe auch Ionizable lipids penetrate phospholipid bilayers with high phase transition temperatures: perspectives from free energy calculations)
Wie wir wissen, sind Rezeptoren, Ionenkanäle und das, was eine Zelle nach innen signalisiert und auch welche Interaktionen nach außen ablaufen, da viele Rezeptoren nur unter bestimmten intrazellulären Bedingungen aktiviert/expressiert werden, stark von der Membranintegrität und Ladung abhängig. Und Rezeptoren (G-Coupled Protein-Rezeptoren, Toll-like Rezeptoren (1,2,4,5,6)), Ionenkanäle, wie der Ca-Kanal, sowie Liganden, wie die Chemokinliganden und auch transmembrangebundene Enzyme, wie ACEII/TMPRSS2, etc) sind der Treiber für jede intrazelluläre Aktion.
Ich gehe gleich wieder in dieses Paper. Doch zuvor sind hier die vermutlich logischsten Erklärungen, warum die Autoren eine Alteration in den MAPks sahen:
Membrane Compartmentation Is Required for Efficient T Cell Activation
Regulation of T cell signalling by membrane lipids
Introducing Membrane Charge and Membrane Potential to T Cell Signaling
Was könnte also schon schiefgehen, mit den zytotoxischen T-Zellen?
Effects of membrane lipids on ion channel structure and function
Physical and Chemical Interplay Between the Membrane and a Prototypical
Potassium Channel Reconstituted on a Lipid Bilayer Platform
Editorial: The key role of lipids in the regulation of ion channels
Wer braucht schon so ein paar feinregulierte Ionenkanäle, wenn er “sicher und wirksam“™ (nicht) vor einem schweren SARS-Cov-2 Verlauf nach der Transfektion geschützt ist?
Role of Membrane Integrity on G protein-coupled Receptors: Rhodopsin Stability and Function
G Protein-Coupled Receptors Regulated by Membrane Potential
Siehe auch:
Plasma membrane integrity in health and disease: significance and therapeutic potential
Da ich noch sehr viel in diesem Substack durchackern muss, kann ich diese Papers leider nicht noch im Detail durchkauen. Das würde eindeutig den Rahmen sprengen. Gehen wir also wieder in das erste Review von Caroline Lonez, Michel Vandenbranden und Jean-Marie Ruysschaert (bemerkenswert: aus dem Jahr 2008).
Wie ihr an dieser wunderschönen Grafik schon erkennen könnt: Hoppla, da scheint ja einiges schief zu gehen.
“Im Rahmen eines kationischen Lipidrezeptors ist es immer noch schwierig zu verstehen, wie so viele strukturell unterschiedliche kationische Lipide „spezifisch“ mit einem Rezeptor interagieren können, und man kann nicht ausschließen, dass andere Membranproteine an der durch kationische Lipide ausgelösten Signalübertragung beteiligt sind.”
2008 erklärten diese Autoren also bereits, dass sie für wesentlich einfachere Nanopartikel (Liposome) keine wirkliche Erklärung der Wirkmechanismen haben. Sie fokussierten sich jedoch zunächst vorrangig auf die TLR4-Expression. Dennoch konnten sie bereits damals nicht ausklammern, dass auch andere membrangebundene Rezeptorproteine oder gar die Membran selbst in die Reaktion involviert sein könnten, was - wie anhand der Beispielpapers gezeigt - wohl niemanden mehr überraschen darf.
Und ab hier beginnt jetzt der echte Alptraum, da Lonez, Vandenbranden und Ruysschaert auf der richtigen Spur waren:
“Eine nicht ausschließliche Alternative zur Rezeptorhypothese könnte darin bestehen, dass sich die Membranumgebung wichtiger Membranproteine beim Einbau kationischer Lipide in die Membrandoppelschicht verändert. In diesem Fall stünden die Auswirkungen kationischer Lipide auf die Zellsignalisierung oder die Zellfunktionen in direktem Zusammenhang mit ihrer Fähigkeit, mit Zellmembranen zu fusionieren. Die Fusion (Lipidmischung) mit der Zellmembran wäre eine Möglichkeit, kationische Lipide in die Lipiddoppelschicht der Plasmamembran und/oder der intrazellulären Membranen einzufügen und die Lipid-Protein-Wechselwirkungen zu verändern, die an der Funktion von Membranproteinen beteiligt sind. Die Fähigkeit kationischer Liposomen, mit (intrazellulären und Plasma-) Zellmembranen zu verschmelzen (wenn auch mit unterschiedlicher Effizienz) wurde durch konfokale Mikroskopie oder (FRET) Förster-Resonanz-Energie-Transfer-Messungen nachgewiesen, auch wenn ein endozytoseähnlicher Mechanismus als Hauptweg der Internalisierung kationischer Komplexe vorgeschlagen wurde. Dennoch besitzen nur wenige kationische Lipide selbst potente fusogene Eigenschaften, darunter diC14-Amidin und DOEPC/ DLEPC. Für die anderen ist die Zugabe von fusogenen Lipiden (wie DOPE) erforderlich, um die Fusion und Interaktion mit Zellen zu fördern. Obwohl die Notwendigkeit einer fusogenen Kapazität von Liposomen, die in Gentransferexperimenten verwendet werden, in Frage gestellt wurde, enthalten viele von ihnen DOPE. Daraus ergibt sich, dass sich sowohl das kationische als auch das Co-Lipid nach der Fusion mit den residenten Membranlipiden vermischen und die normale Membranzusammensetzung verändern dürften. Wie die Zelle auf eine solche Störung reagiert, ist weitgehend unbekannt, obwohl es einige neuere Berichte gibt, die die Folgen solcher Veränderungen zeigen (siehe Abschnitt 3.1), hauptsächlich im Bereich der Entzündungsreaktionen. Die Hemmung des proinflammatorischen Zytokins TNF-a wurde mit hoch fusogenen diC14-Amidin-Liposomen, die ein Phospholipid enthalten, beobachtet. Die Tatsache, dass bei einem weniger fusogenen kationischen Lipid (DOTAP) (in Verbindung mit einem Phosphatidylcholin) keine Hemmung der TNF-a-Sekretion festgestellt wurde, könnte darauf hindeuten, dass die Fusion mit der Plasma- oder Endosomenmembran eine Voraussetzung für die kationisch vermittelte entzündungshemmende Wirkung sein könnte. Im Gegensatz zu den DOTAP-Liposomen besitzt DiC14-Amidin in Abwesenheit von DOPE eine starke Fusionsfähigkeit. Die Anwesenheit eines Phospholipids ist jedoch erforderlich, um entzündungshemmende Reaktionen hervorzurufen. Die endosomale Freisetzung nach der Fusion zwischen der endosomalen Membran und den kationischen Liposomen könnte den Zugang (für Phospholipide) zu intrazellulären Rezeptoren (einschließlich der peroxisomalen proliferationsaktivierten Rezeptoren) ermöglichen, die an der durch Phospholipide vermittelten entzündungshemmenden Wirkung beteiligt sind. Diese Rezeptoren, die sich in der Kernperipherie befinden, interagieren mit verschiedenen Phospholipidkomponenten des Serums und sind an entzündungshemmenden Prozessen beteiligt.”
Ersetzen wir doch einfach das niedlich klingende Wort “fusionieren” durch penetrieren. Und damit haben wir auch schon den Basismechanismus erörtert.
Die Autoren feuerten ein weiteres Review nach, welches 2012 erschien:
Cationic lipids activate intracellular signaling pathways
“Endozytose oder endozytoseähnliche Mechanismen sind die Hauptwege der Internalisierung von Lipoplexen (kationische Liposomen/DNA-Komplexe), auch wenn die genaue Art der beteiligten endozytischen Vesikel noch umstritten ist. Die kationischen Ladungen könnten zur Invasion der Zellplasmamembran beitragen, indem sie die Umhüllung der komplementär geladenen Zellmembran um die Lipoplexe erzwingen, und eine wichtige Rolle bei den ersten Schritten des Endozytoseprozesses der Lipoplexe spielen. Der Mechanismus des Entweichens der Komplexe aus den Endosomen ist noch unklar. Die Fusion der Lipoplexe mit der endosomalen Membran wird allgemein als ein möglicher Weg zur Freisetzung von DNA und/oder Lipoplexen in das Zytoplasma akzeptiert.”
“Die hohe Dichte positiver Ladungen an der Oberfläche von Liposomen verstärkt ihre Adsorption an der negativ geladenen Zelloberfläche drastisch. Die Hemmung der Bindung kationischer Liposomen an der Zelloberfläche durch Trypsin-Behandlung deutet darauf hin, dass die Bindung kationischer Liposomen eine Membranproteinkomponente beinhaltet, schließt aber den Beitrag negativ geladener extrazellulärer Matrix-Zellkomponenten nicht aus. Kationische Vesikel dringen durch spezifische Mechanismen in Zellen ein und transportieren intrazellulär Nukleinsäuren, funktionelle Proteine oder Antigene.”
Wie wir also hierbei unschwer erkennen können:
Es führt kein weg an den MAPks vorbei. Doch was meine Freunde Lonez, Vandenbranden und Ruysschaert vermutlich aus Engstirnigkeit und dem festen Willen, diese Tech müsse ja irgendwann funktionieren, ignorierten, werde ich mit euch gleich unter Punkt 3 diskutieren:
”Zusammenfassend haben wir hier mehrere Eigenschaften von kationischen Lipiden beschrieben, die Zellsignalwege aktivieren, einschließlich pro-inflammatorischer und pro-apoptotischer Wege. In Anbetracht der Vielfalt der bereits verfügbaren oder entwickelbaren kationischen Lipide und der Vielzahl potenzieller Angriffspunkte ist es sehr wahrscheinlich, dass bisher nur wenige solcher von kationischen Lipiden abhängigen Aktivitäten identifiziert wurden. In dieser Hinsicht werden sich wahrscheinlich neue Möglichkeiten für kationische Lipide auf dem Gebiet der Pharmakologie und Immunologie ergeben. Ein tieferes Verständnis der Beziehung zwischen Struktur und zellulären Aktivierungswegen wird in den kommenden Jahren zur Entwicklung von kationischen Lipiden führen, die auf eine bestimmte Anwendung zugeschnitten sind.”
Oh diese Hybris und Arroganz.
Genau! Weil wir ja Signaltransduktion schon so wunderprächtig 2020 begriffen, war es kein großes Ding mehr, wohlwissend, dass dies passieren MUSS, einfach mal Milliarden zu transfizieren.
Und wie sich herausstellt, lag ich mit meinem Substack bedauerlicherweise mehr als richtig, wie folgende - frisch von mir entdeckte - Papers zeigen, anzunehmen, dass der gesamte PtdIns-Zyklus zum Teufel gejagt wird:
Endosomal escape: A bottleneck for LNP-mediated therapeutics
“Der Reifungsprozess von frühen Endosomen zu späten Endosomen erfolgt in verschiedenen Schritten, zu denen u. a. der RAB-Switch (von RAB5 zu RAB7), die Ansäuerung (von pH~6,2 zu pH 6 - 4,9), die Bildung von ILVs (intralamellare Vesikel), die PI-Umwandlung (von PI3P zu PI2P) und der Zuwachs an lysosomalen Hydrolasen und Membranproteinen gehören. So sind für ein kurzes Intervall sowohl RAB5 als auch RAB7 in endosomenbildenden transienten frühen und späten Endosomen vorhanden, die als wichtiges Kompartiment für die Freisetzung von siRNA-LNPs gelten. Späte Endosomen teilen viele Eigenschaften mit Lysosomen, was ihre Unterscheidung erschwert und eine technische Einschränkung für Forscher auf diesem Gebiet darstellt. Cargos, die in späte Endosomen überführt werden, gelten als eine Sackgasse, in der die Moleküle schließlich in Lysosomen überführt und abgebaut werden.”
Und das ist eben genau das Problem, welches bereits zu akuten intrazellulären Schäden führen wird, da auch der endosomale Escape absolut engmaschig durch den PtdIns-Zyklus reguliert wird, genauso, wie die Membranreorganisation nach Endozytose.
“Unsere Ergebnisse zeigen zum ersten Mal, dass Galektine nach einer LNP-induzierten endosomalen Schädigung eine entzündungsfördernde Wirkung haben. Dies könnte auf mehrere Mechanismen zurückzuführen sein, die weiter untersucht werden sollten. Es hat sich gezeigt, dass Galektine die Aktivierung des NLRP3-Inflammasoms fördern, insbesondere in Makrophagen. Unsere Daten stehen im Einklang mit dem Zusammenhang zwischen der endosomalen Flucht von LNP, Galectinen und der Aktivierung des Inflammasoms: Die Hemmung von Galektinen reduzierte die Konzentration von IL-1β (in Fällen, in denen dieses Zytokin durch LNPs hochreguliert wird), das durch das NLRP3-Inflammasom produziert wird (ergänzende Abb. 17). In Anbetracht der Tatsache, dass Galektine die Rekrutierung von Leukozyten fördern, indem sie die Adhäsion von Immunzellen oder die Chemoattraktion modulieren, haben wir gezeigt, dass die intratracheale Galektinhemmung die LNP-induzierte Leukozyteninfiltration in den Alveolarraum verbessert (Abb. 4F) und die intravenöse Galektinhemmung die LNP-induzierte Erhöhung der zirkulierenden Leukozyten reduziert (Abb. 4D).”
(‼pre-print‼ - Wobei ich mittlerweile dazu tendiere, zu sagen: Scheiß auf ein Peer review bei dem über 50 Prozent der Reviewer direkte finanzielle Interessenskonflikte haben! Es lohnt sich eher ein expansiver Blick in den Methodikteil und natürlich der Blick in die Interessenskonflikte:
“More than half (54.0%) of reviewers accepted general payments, while 31.8% received research payments. Reviewers received $1.06 billion in industry payments between 2020 and 2022, including $1.00 billion (94.0%) to individuals or their institutions and $64.18 million (6.0%) in general payments.”
„Mehr als die Hälfte (54,0 %) der Gutachter nahmen allgemeine Zahlungen an, während 31,8 % Zahlungen für die Forschung erhielten. Die Gutachter erhielten zwischen 2020 und 2022 Zahlungen der Industrie in Höhe von 1,06 Mrd. USD, davon 1,00 Mrd. USD (94,0 %) an Einzelpersonen oder deren Institutionen und 64,18 Mio. USD (6,0 %) an allgemeinen Zahlungen.")